
题目列表(包括答案和解析)
15、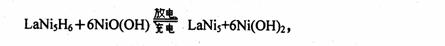 2005年2月14日新华社报道,我国镍氢电池居世界先进水平,我军潜艇将装备国产大功率镍氢动力电池,。常见镍氢电池的某极是储氢合金LaNi5 (LaNi5H6中各元素化合价均为零),电池反应通常表示为
2005年2月14日新华社报道,我国镍氢电池居世界先进水平,我军潜艇将装备国产大功率镍氢动力电池,。常见镍氢电池的某极是储氢合金LaNi5 (LaNi5H6中各元素化合价均为零),电池反应通常表示为
下列说法正确的是
A.放电时储氢合金作正极 B.充电时储氢合金作阴极
C.充电时阳极周围c(OH-)增大 D.放电时负极反应:LaNi5H6+6OH--6e-=LaNi+6H2O
14、可逆反应2SO2(g) + O2(g) ⇌ 2SO3 (g) 从正反应方向开始,并达到了平衡。此时SO2和O2的物质的量之比为2∶1;若采取某种措施,导致SO2和O2又消耗了一些,并再次达到到平衡,下列说法正确的是
A.新平衡体系中,SO2和O2物质的量之比仍为2∶1
B.平衡向正反应方向移动了,原因是正反应速率增大了,逆反应速率减小了
C.新平衡体系与旧平衡体系比较,SO3的浓度肯定增大了
D.若所采取的措施是缩小容器的容积,则新平衡SO2和O2转化率之比和旧平衡中SO2和O2的转化率之比都是1∶1
13、合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:N2(g )+3H2(g) 2NH3(g),△H ﹤0。673K、30Mpa下n(NH3)和n(H2)随时间变化的
2NH3(g),△H ﹤0。673K、30Mpa下n(NH3)和n(H2)随时间变化的
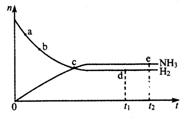 关系如图所示。下列叙述正确的是:( )
关系如图所示。下列叙述正确的是:( )
A.点a的正反应速率比点b的大
B.点c处反应达到平衡
C.点d(t1时刻)和点e(t2时刻)处n(N2)不一样
D.其他条件不变,773K下反应至t1时刻,
n(H2)比图中d点的值小
12、下列各溶液中,微粒的物质的量浓度关系不正确的是: ( )
A、10mL 0.5mol/L CH3COONa溶液和6mL 1mol/L盐酸混合:c(Cl-)>c(Na+)>c(H+)>c(OH-)
B.0.1mol/L pH为4的NaHB溶液中:c(HB-)>c(B2-)>c(H2B)
C.在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+c(A2-)
D. c(NH4+)相等的(NH4)2SO4溶液、(NH4)2CO3溶液和NH4Cl溶液:
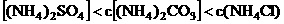 c
c
11、设NA为阿伏加德罗常数,下列叙述合理的是:
A.通常状况下,1molNaHCO3投入足量稀盐酸中,反应完后,可逸出NA个CO2分子
B.在含有1mol CH3COO-的醋酸钠溶液中, Na+数目略大于NA
C.46gNO2和N2O4混合气体中含有原子数为3NA
D.22.4L的O3分子所含原子数为3NA
10、X、Y、Z、W为四种短周期主族元素。其中X、Z同族,Y、Z同周期,W与X、Y既不同族也不同周期;X原子最外层电子数是核外电子层数的3倍;Y的最高正价与最低负价的代数和为6。下列说法正确的是
A.Y元素最高价氧化物对应水化物的化学式为H2YO4 B.原子半径由小到大的顺序为:W<X<Y<Z
C.X与W可以形成W2X、W2X2两种氧化物
D.Y、Z两元素的气态氢化物中,Z的气态氢化物最稳定
9、下列各种溶液中,一定不能大量共存的离子组是
A、pH=0的溶液中:Fe2+、NO3-、SO42-、I-
B、由水电离的c(H+)=10-14mol·L-1的溶液中: K+、Na+、Ca2+、HCO3-
C、含有大量Fe3+的溶液中:Mg2+、Al3+、Cu2+、SO42-
D、使紫色石蕊试液变蓝色的溶液中:Na+、AlO2-、S2-、SO42-
8、工业上以Ca(OH)2和HNO3为原料制备Ca(NO3)2·4H2O晶体,若制备过程中容器内所有H、O原子均转化为结晶水,则所用硝酸溶液中溶质的质量分数为( )
A、30% B、63%
C、78% D、无法计算
7、在一密闭容器中有如下反应:aX(g)+bY(g) nW(g);ΔH
,某化学兴趣小组的同学根据此反应在不同条件下的实验数据,作出了如下曲线图:
nW(g);ΔH
,某化学兴趣小组的同学根据此反应在不同条件下的实验数据,作出了如下曲线图:
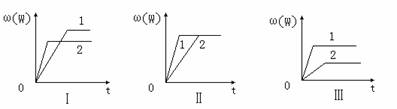
其中,ω(W)表示W在反应混合物中的百分含量,t表示反应时间。当其它条件不变时,下列分析正确的是
A.图Ⅰ可能是不同压强对反应的影响,且P2>P1,a+b>n
B.图Ⅱ可能是在同温同压下催化剂对反应的影响,且1使用的催化剂效果好
C.图Ⅱ可能是不同压强对反应的影响,且P1>P2,n<a+b
D.图Ⅲ可能是不同温度对反应的影响,且T1>T2,ΔH<0
6、下列各组稀溶液,不用其它试剂就可以将它们区别开的是:
A.盐酸、氢氧化钾、硫酸钾、碳酸钾
B.硝酸钠、盐酸、氯化铵、氢氧化钾
C.氢氧化钾、碳酸钾、硫酸镁、硫酸氢钾
D. 氯化钡、氯化钙、硫酸钠、硝酸钾
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com