
题目列表(包括答案和解析)
25、(共10分)硝酸工业生产中的尾气可用纯碱溶液吸收,有关的化学反应为:
2NO2 + Na2CO3 → NaNO2 + NaNO3 + CO2↑ ①
NO + NO2 + Na2CO3 → 2NaNO2 + CO2↑ ②
⑴ 根据反应①,每产生22.4L(标准状况下)CO2,吸收液质量将增加___________g。
⑵ 配制1000g 质量分数为21.2%的纯碱吸收液,需Na2CO3·10H2O g。
⑶ 现有1000g 质量分数为21.2%的纯碱吸收液,吸收硝酸工业尾气,每产生22.4L(标准状况下)CO2时,吸收液质量就增加44g。
① 计算吸收液中NaNO2 和NaNO3 的物质的量之比
② 1000g 质量分数为21.2%的纯碱在20℃经充分吸收硝酸工业尾气后,蒸发掉688g水,
冷却到0℃,最多可析出NaNO2多少克?(0℃时,NaNO2的溶解度为71.2g/100g水)
24、(8分)能源是人类社会发展进步的物质基础。在当代,能源同信息、材料一起构成了现代文明的三大支柱。
(1)为了降低汽车尾气对大气的污染,江苏有关部门拟用甲醇替代液化石油气作为公交车的燃料。已知在:25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ。则甲醇的燃烧热为__________________________________________________________
(2)测定工业甲醇中CH3OH的质量分数可用下法:取0.1000g工业甲醇样品,以适量H2SO4酸化后,加入20.00mL 0.2000mol/L的K2Cr2O7溶液,再用0.3000mol/L(NH4)2Fe(SO4)2标准溶液滴定,耗去此标准液20.00mL时,刚好到达滴定终点。
已知CH3OH+Cr2O72-+8H+=CO2↑+2Cr3++6H2O
①写出H2SO4酸化的K2Cr2O7溶液与(NH4)2Fe(SO4)2溶液反应的离子方程式。
②求此工业甲醇中CH3OH的质量分数。
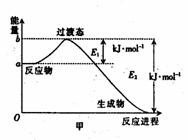
22、(8分)(1)20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成,而是在反应物到生成物的过程中经过一个高能量的过渡态。图甲 是白磷(P4)和O2反应生成P4O10过程中能量变化示意图,请写出白磷(P4)和O2反应生成P4O10的热化学方程式:
_____________________________________________(△H用含E1和E2的代数式表示,其中E1、E2均大于0)。
(2)白磷(图乙)是正四面体构型的分子,当与氧气作用形成P4O6时,相当于每两个磷原子之间插入一个氧原子(如图丙)。当形成P4O10时,相当于在P4O6的分子中每个磷原子又以双键结合一个氧原子(如图丁)。
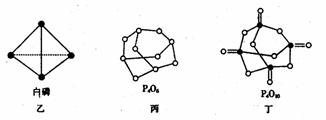
请在图丙的示意图中把磷原子用钢笔或铅笔把磷原子涂黑。
(3)进一步研究表明,化学反应的能量变化(△H)与反应物和生成物的键能有关。键能可以简单的理解为断开1mol化学键时所需吸收的能量。下表是部分化学键的键能数据:
|
化学键 |
P-P |
P-O |
O=O |
P=O |
|
键能/kJ·mol-1 |
198 |
360 |
498 |
X |
已知白磷(P4)的燃烧热为2982 kJ·mol-1,白磷完全燃烧的产物结构如图丁所示,则上表中x=________________
(4)写出1molP4与O2反应生成固态P4O6的反应热△H=_____________。
21、(10分)已知A、B、E是固体化合物,D、G是固体单质,X、Z、F为可燃性气体,F、X的火焰呈淡蓝色,他们之间有如下转化关系:
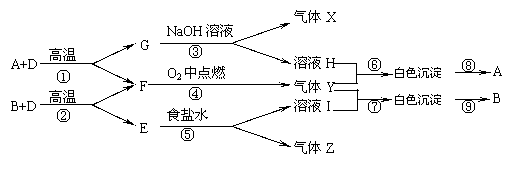
⑴写出A、B、Z的名称:A ,B ,Z
⑵写出Y的结构式: ,A的晶体结构类型: ,
溶液H的保存要求 ;
⑶按要求写出反应方程式:
①的化学方程式:
 ⑥离子方程式:
⑥离子方程式:
20、(8分)在恒温、恒压和使用催化剂的条件下,已知:在容积可变的密闭容器中,充入1 L含3mol H2和1 mol N2混合气体,反应达平衡时有a mol NH3生成,N2的转化率为b %。
(1)若在恒温、恒压和使用催化剂的条件下,在体积可变的密闭容器中充入x mol H2和y mol N2,反应达平衡时有3a mol NH3生成,N2转化率仍为b %。则x=______;y=_______。
(2)在恒温、恒压和使用催化剂的条件下,设在体积可变的密闭容器中充入x mol H2、y mol N2和z mol NH3,若达平衡时N2转化率仍为b %,则x、y的关系为_______________z的取值范围为_____________。
(3)在恒温(与(1)温度相同)和使用催化剂的条件下,在容积不可变的密闭容器中,充入1 L含3 mol H2和1 mol N2混合气体,反应达平衡时N2的转化率为c %,则b、c的关系为___ ___(用“<”、“=”或“>”表示),理由是 。
19、(8分)第一电离能I1是指气态原子X(g)处于基态时,失去一个电子成为气态阳离子X+(g)所需的能量。下图是部分元素原子的第一电离能I1随原子序数变化的曲线图。
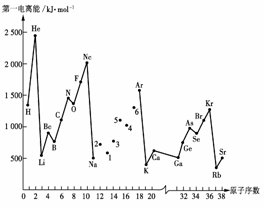
请回答以下问题:
(1)认真分析上图中同周期元素第一电离能的变化规律,将Na--Ar之间六种元素用短线连
接起来,构成完整的图像。
(2)从上图分析可知,同一主族元素原子的第一电离能I1变化规律是______________;
(3)上图中5号元素在周期表中的位置是________________________________________;
(4)上图中4、5、6三种元素的气态氢化物的沸 点 均比同主族上一周期的元素气态氢化物低很多,原因是: __________ 。
18、(14分)目前测定空气中SO2含量主要用氧化还原反应。已知SO2气体与酸性KMnO4溶液反应时,MnO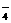 被还原为Mn2+,SO2被氧化成SO
被还原为Mn2+,SO2被氧化成SO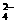 。为测定某地方的空气中SO2和可吸入颗粒的含量,甲同学设计了如下图所示的实验装置:
。为测定某地方的空气中SO2和可吸入颗粒的含量,甲同学设计了如下图所示的实验装置:
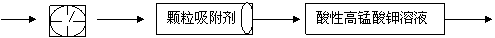


 ①其中: 或 表示密闭容器;
表示气体流速管(单位时间内通过
①其中: 或 表示密闭容器;
表示气体流速管(单位时间内通过

 气体的体积恒定,且无除尘和吸收气体作用); 表示棉花;颗粒吸附剂可以吸收可吸入的颗粒; 表示气体的流向。②酸性KMnO4溶液体积为200mL,浓度为0.1mol·L-1。
气体的体积恒定,且无除尘和吸收气体作用); 表示棉花;颗粒吸附剂可以吸收可吸入的颗粒; 表示气体的流向。②酸性KMnO4溶液体积为200mL,浓度为0.1mol·L-1。
回答下列问题:
(1)配制200mL0.1mol·L-1酸性KMnO4溶液,需用到的仪器按使用的先后顺序依次有 、玻璃棒、 、 、 。玻璃棒的作用是 。
(2)写出并配平测定SO2含量的离子方程式:
(3)若气体流速管中气体流速为a cm3/min,当t min时酸性KMnO4溶液恰好褪色,则空气中
SO2的含量为 (g/cm3)。
(4)实验中棉花的作用是______________________________________________;若要测定空气中可吸入颗粒的含量(g/L),还需要测出的数据是 。
(5)乙同学按照同样的方法测量空气中SO2的含量,所测得的数值总是比实际含量偏低,最可能的原因是(假设溶液配制、称量或量取及各种读数均无错误): _。
17、(8分)摩尔盐[(NH4)2SO4·FeSO4·6H2O]在空气中比一般亚铁盐稳定,是分析化学中常见的还原剂。某研究性学习小组设计了下面的实验装置来制备摩尔盐。
实验步骤:
(1)把30%NaOH溶液和废铁屑混合、煮沸、冷却,将洗涤铁屑后的NaOH溶液装入F中。
(2)在E中用处理过的Fe屑和稀H2SO4反应制取FeSO4。
(3)将硫酸亚铁溶液与硫酸铵溶液混合,结晶得摩尔盐。
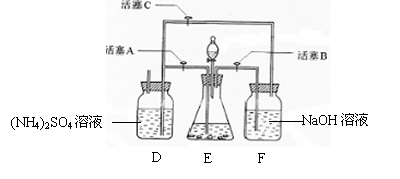
试回答下列问题:
(1)Fe屑和稀H2SO4反应产生的氢气可赶走装置中的氧气及(NH4)2SO4溶液中的溶解氧,操作时应先关闭活塞 ,并同时打开活塞 。
请写出Fe屑和稀H2SO4反应产生的氢气的另外一个作用
(2)使摩尔盐结晶可采取两种方法:①蒸发溶液、再自然冷却结晶;②不蒸发溶液、直接自然冷却结晶。你认为较好的方法是 。(填序号)
(3)原料利用率高,副产品少,产生的有害废物少,保护环境是“绿色化学”的主要内涵。
请写出此实验中能体现“绿色化学”的具体做法(至少写出两点):
、 。
16、下表中,对陈述Ⅰ、Ⅱ的正确性及两者间是否具有因果关系的判断都正确的是
|
选项 |
陈 述 Ⅰ |
陈 述 Ⅱ |
判 断 |
|
A |
工业生产硫酸用水吸收SO3 |
SO3可与水反应 |
Ⅰ对;Ⅱ对;有 |
|
B |
工业上用废铁屑与硫酸制备FeSO4时通常向反应溶液中加入洁净的废铁屑 |
铁可以还原Fe3+成Fe2+ |
Ⅰ对;Ⅱ对;有 |
|
C |
江河的入海处易形成“三角洲” |
胶体是一种相对稳定的 分散系 |
Ⅰ对;Ⅱ错;无 |
|
D |
石墨常用作电解池的电极 |
石墨的化学性质稳定且 导电性好 |
Ⅰ对;Ⅱ对;有 |
第Ⅱ卷(共86分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com