
题目列表(包括答案和解析)
23.(9分)有X、Y、Z三种元素,已知:
①X2-、Y--均与Y的气态氢化物分子具有相同的电子数;
 ②Z与Y可组成化合物ZY3,ZY3溶液遇苯酚呈紫色。
②Z与Y可组成化合物ZY3,ZY3溶液遇苯酚呈紫色。
请回答:
(1)Y的最高价氧化物对应水化物的化学式是 。
(2)将ZY3溶液滴入沸水可得到红褐色液体,反应的离子方程式是 ,
此液体具有的性质是 (填写序号字母)。
a.光束通过该液体时形成光亮的“通路”
b.插入电极通过直流电后,有一极附近液体颜色加深
c.向该液体中加入硝酸银溶液,无沉淀产生
d.将该液体加热、蒸干、灼烧后,有氧化物生成
(3)X单质在空气中燃烧生成一种无色有刺激性气味的气体。
①已知一定条件下,每1 mol该气体被O2氧化放热98.0KJ。若2 mol该气体与1 mol O2在此条件下发生反应,达到平衡时放出的热量是176.4 kJ,则该气体的转化率为 。
②原无色有刺激性气味的气体与含1.5 mol Y的一种含氧酸(该酸的某盐常用于实验室制取氧气)的溶液在一定条件下反映,可生成一种强酸和一种氧化物,若1.5×6.02×10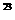 个电子转移时,该反应的化学方程式是
。
个电子转移时,该反应的化学方程式是
。
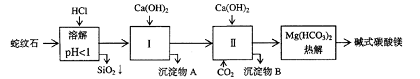
22.(12分)蛇纹石矿可以看作由MgO、Fe2O3、Al2O3、SiO2组成。由蛇纹石制取碱式碳酸镁的实验步骤如下
|
氢氧化物 |
Fe(OH)3 |
Al(OH)3 |
Mg(OH)2 |
|
开始沉淀pH |
1.5 |
3.3 |
9.4 |
(1) 蛇纹石矿加盐酸溶解后,溶液里除了Mg2+外,还含有的金属离子是
(2)进行Ⅰ操作时,控制溶液pH=7-8(有关氢氧化物沉淀的pH见右表)Ca(OH)2不能过量原因是
(3)从沉淀混合物A中提取红色氧化物作颜料的方法是
(4)现设计一个实验,确定产品aMgCO3·bMg(OH)2·cH2O中a、b、c的值,请完善下列实验步骤(可用试剂:浓硫酸、碱石灰):
①样品称量 ②高温分解 ③____________________________________
④________________________ ⑤MgO称量
(5)18.2g产品完全分解后,产生6.6gCO2和8.0g MgO,由此可知,产品的化学式中:
a=_________ b =_________ c=_________
21. (4分)有一澄清透明的溶液中,可能含有下列离子:K+、Fe3+、 Ba2+ 、Al3+ 、Cl- 、NO3- 、HCO3- 、SO42-。现做以下实验:
⑴.取样测定溶液的酸碱度发现pH=1。
⑵.取少量溶液,加入用稀HNO3酸化的BaCl2溶液,产生白色沉淀;
⑶.将⑵中的沉淀过滤,向滤液中加入AgNO3溶液,产生白色沉淀;
⑷.另取溶液,逐滴加入NaOH溶液至过量,只看到有红褐色沉淀生成,且沉淀质量不减少。由此可推断:
溶液中肯定存在的离子有:_______________________.
溶液中肯定不存在的离子有:_______________________.
20. 过氧化氢俗称双氧水,它是一种液体,易分解为水和氧气,常作氧化剂、漂白剂和消毒剂,为贮存、运输、使用的方便,工业常将H2O2转化为固态的过碳酸钠晶体(其化学式为2Na2CO3 ·3H2O2),该晶体具有Na2CO3和H2O2的双重性质。下列物质不会使过碳酸钠晶体失效的是( )
A.H2S B.NaHCO3 C.稀盐酸 D.MnO2
第Ⅱ卷 (非选择题,共50分)
注意:21-22两小题答案写在第6页下面横线上
18.有一瓶无色气体,可能含有CO2、HCl、HBr、SO2中的若干种,将其通入氯水中,得无色透明液,将此溶液分成两份,向其中一份加入盐酸酸化的BaCl2溶液有白色沉淀;向另一份中加入HNO3酸化的AgNO3溶液有白色沉淀产生,则下列结论正确的是( ) A.肯定有CO2和SO2 B.可能有HBr、CO2 C.肯定没有HBr、HCl D.以上结论均不正确 19.将ag含NaOH样品溶解在bmL0.1mol·L-1的H2SO4中,再加入cmL0.1mol·L-1的Ba(OH)2溶液,反应后的溶液恰好呈中性,则样品中NaOH的纯度是( )
A.[(b-c)/125a]×100% B.[(b-2c)/125a]×100%
C.[(b-c)/250a]×100% D.[(8b-8c)/a]×100%
17.已知溶质的质量分数为95%酒精溶液的物质的量浓度为16.52mol.L-1,试判断溶质质量分数为47.5%酒精溶液的物质的量浓度为( )
A.小于8.26 mol.L-1 B.等于8.26 mol.L-1
C.大于8.26 mol.L-1 D.无法判断
16.把27.2 g Fe和Fe2O3的混合物溶于500mL稀H2SO4,完全反应后放出标准状况下的H2 4.48L,向该溶液中滴入少量NH4SCN溶液,无颜色变化。再加入2 mol.L-1的NaOH溶液,至pH=7时,共消耗NaOH溶液500mL。则原稀H2SO4的物质的量浓度为( )
A.1 mol.L-1 B. 2 mol.L-1 C.3 mol.L-1 D.4 mol.L-1
15. 吸进人体内的O2有2%转化为氧化性极强的活性氧副产物,如 等,这些活性氧能加速人体衰老,被称为“夺命杀手”。我国科学家尝试用含硒化合物Na2SeO3消除人体内的活性氧,在消除活性氧时,Na2SeO3的作用是( )
等,这些活性氧能加速人体衰老,被称为“夺命杀手”。我国科学家尝试用含硒化合物Na2SeO3消除人体内的活性氧,在消除活性氧时,Na2SeO3的作用是( )
A.还原剂 B.氧化剂
C.既是氧化剂,又是还原剂 D.以上均不是
14.甲、乙两同学从同一溶液中各取出100g做如下实验:甲将溶液蒸发掉20g水后冷却到室温,析出3.6g晶体(不含结晶水);乙将溶液蒸发掉30g水后冷却到室温,析出6.0晶体,若两同学实验都正确无误,则100g该溶液蒸发掉10g水并冷却到室温时,析出晶体的质量为( )
A.0 B.1.2g
C.2.4g D.9.6g
13.向各盛有1L水的A、B、C、D四个烧杯中分别加入等物质的量的钠、氧化钠、过氧化钠和氢氧化钠,固体完全溶解后,各杯溶液中溶质的质量分数的顺序是
A . D>C>B>A B. B=C>A>D C. B=C>A=D D . B>C>A>D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com