
题目列表(包括答案和解析)
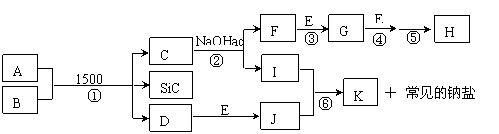
19.(10分)下图是一些常见元素的单质或化合物之间的转化关系。溶液中的水以及部分反
应物或生成物未标出。A、E是空气中的两种主要成分,C是由两种元素组成的新型材料,
且和SiC具有相同的价电子数和原子数,J是一种能引起温室效应的气体,K是两性化合物。
反应③、④、⑤用于工业中生产H。
回答下列问题:
(1)写出下列物质的化学式:F ,I ;
(2)写出反应③的化学方程式: ;
(3)写出反应⑥的离子方程式: ;
(4)B和SiC的纳米级复合粉末是新一代大规模集成电路理想的散热材料。反应①是科学家研究开发制备该纳米级复合粉末的最新途径。已知B由Si及另外两种元素组成,且Si与另外两种元素的物质的量之比均为1∶4,写出反应①的化学方程式: 。
18.(9分)现有含NaCl、Na2SO4、NaNO3的混合溶液,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl-、SO42-、NO3-的相互分离。相应的实验过程可用下图表示:


(1) 写出上述实验过程中所用试剂的名称:
试剂1____ _______试剂2______ _______试剂4______ __________
(2)恰当地控制试剂4的加入量的方法是______________ ___________________
(3)加入过量试剂3的目的是__________________ ____________
(4)在加入试剂4后,获得固体D的实验操作④是_____________________(填操作名称)
17.(12分)过氧化氢是一种无色透明的无毒液体,是重要无机化工产品。试探究下列问题
(1)过氧化氢最适合贴上的一个标签是 。
|

(2)过氧化氢的制备方法很多,下列方法中原子利用率最高的是: 。
A. BaO 2 + H2SO 4 === BaSO4 ↓ + H2O2
B. 2NH4HSO4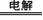 (NH4)2S2O8 + H2↑,
(NH4)2S2O8 + H2↑,
然后水解 (NH4)2S2O8 + 2H2O =2NH4HSO4 + H2O2。
C.CH3CHOHCH3+O2→CH3COCH3+H2O2
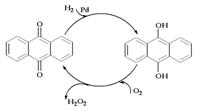
D.乙基蒽醌法:
(3)碱性氢氧燃料电池工作时可产生过氧化氢(见下左图),正极含碳(Carbon)的质量大小对产生过氧化氢的浓度(concentration)有影响(其影响曲线如下右图)。
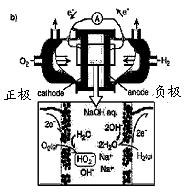
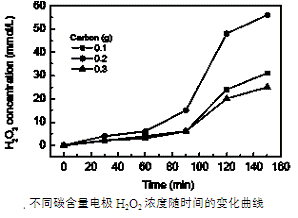
下列说法正确的有 。
A.开始时速率均较慢,说明电极有一个活化的过程
B.一段时间后,速率又再次平缓,说明生成与分解逐渐趋向平衡
C.正极室流出液经酸化后可分离出过氧化氢
D.正极含碳的质量以0.2g适宜
(4)过氧化氢作为一种绿色氧化剂有广泛应用,请写出下列反应的化学方程式:
①在过氧化氢作用下,铜与稀硫酸制硫酸铜: 。
②用Ti-Si分子筛作催化剂,甲苯被过氧化氢氧化为间-甲苯酚: 。
16.(12分)三氧化二铁和氧化亚铜都是红色粉末,常用作颜料。某校一化学实验小组通过实验来探究一红色粉末是Fe2O3、Cu2O或二者混合物。探究过程如下:
查阅资料:Cu2O是一种碱性氧化物, 溶于稀硫酸生成Cu和CuSO4, 在空气中加热生成CuO
提出假设
假设1:红色粉末是Fe2O3
假设2:红色粉末是Cu2O
假设3:红色粉末是Fe2O3和Cu2O的混合物
设计探究实验
取少量粉末放入足量稀硫酸中,在所得溶液中再滴加 KSCN 试剂。
(1)若假设1成立,则实验现象是 。
(2)若滴加 KSCN 试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁。你认为这种说法合理吗? 简述你的理由(不需写出反应的方程式 )
。
(3)若固体粉末完全溶解无固体存在 , 滴加 KSCN 试剂时溶液不变红色 , 则证明原固体粉末是 ,写出发生反应的离子方程式 、 、 。
探究延伸
经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物。
(4) 实验小组欲用加热法测定Cu2O的质量分数。取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg(b > a),则混合物中Cu2O的质量分数为 。
15.(12分)近年来,江苏省酸雨污染较为严重,防治酸雨成了迫在眉睫的问题。
⑴有人提出了一种利用氯碱工业产品治理含二氧化硫废气的方法,流程如下: ( I )将含SO2的废气通入电解饱和食盐水所得溶液中,得NaHSO3溶液。(Ⅱ)将电解饱和食盐水所得气体反应后制得盐酸。(III)将盐酸加入NaHSO3溶液中得SO2气体回收,生成的NaCl循环利用。
① 写出步骤(I)反应的化学方程式:
② 写出步骤(III)反应的离子方程式:
⑵还有学者提出利用 Fe 2十、Fe3十等离子的催化作用,常温下将SO2氧化成SO42一而实现SO2的回收利用。某研究性学习小组据此设计了如下方案,在实验室条件下测定转化器中SO2氧化成SO42一的转化率。
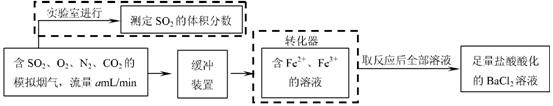
① 该小组采用下图装置在实验室测定模拟烟气中SO2的体积分数,X溶液可以是 。
A.碘的淀粉溶液 B.酸性高锰酸钾溶液 C.氢氧化钠溶液 D.氯化钡溶液
② 若上述实验是在标准状况下进行的,欲测定转化器中SO2氧化成SO42一的转化率,已知气体流速,还需测定的数据是
14.Cu2S与一定浓度的HNO3反应,生成Cu(NO3)2、CuSO4、NO2、NO和H2O,当NO2和NO的物质的量之比为1∶1时,实际参加反应的Cu2S与HNO3的物质的量之比为
A.1∶9 B.1∶5 C.1∶7 D.2∶9
13.(CN)2、(SCN)2等的性质与卤素单质相似,在化学上称为“类卤素”;CN-、SCN-等的性质也与卤离子相似,称为“类卤离子”;不同卤原子能组成卤素互化物,如溴化碘IBr,下面关于(CN)2的性质中,不像卤素的是
A.在碱溶液中生成CN-和OCN- B.跟卤素反应生成CNCl、CNBr等
C.能在空气中燃烧 D.可与银反应生成可溶盐
12.为确定某含一种溶质形成的溶液的离子组成,进行如下实验:
①测定溶液的pH,溶液显强碱性。
②取少量溶液加入稀盐酸至溶液呈酸性,产生无刺激性、能使澄清石灰水变浑浊的气体。
③在上述溶液中再滴加Ba(NO3)2溶液,产生白色沉淀。
④取上层清液继续滴加Ba(NO3)2溶液至无沉淀时,再滴加Ag NO3溶液,产生白色沉淀。
根据实验以下推测正确的是
A.一定有SO32-离子 B.一定有CO32-离子
C.不能确定C1-离子是否存在 D.不能确定HCO3-离子是否存在
11.向一定量的K2CO3溶液中缓慢滴加稀盐酸,并不断搅拌。随着盐酸的加入,溶液中离子数目也相应地发生变化。如图所示,四条曲线与溶液中的离子的对应关系,完全正确的是
|
|
a |
b |
c |
|
||
|
A |
Cl- |
K+ |
CO32- |
HCO3- |
||
|
B |
K+ |
CO32- |
Cl- |
HCO3- |
||
|
C |
K+ |
CO32- |
HCO3- |
Cl- |
||
|
D |
K+ |
HCO3- |
Cl- |
CO32- |
10.在浓盐酸中H3AsO3与SnCl2反应的离子方程式为:3SnCl2+12Cl-+2H3AsO3+6H+=2As+3SnCl62-+6M。关于该反应的说法中正确的组合是 ( )
① 氧化剂是H3AsO3;
② 还原性:Cl->As;
③ 每生成7.5gAs,还原剂失去的电子为0.3 mol;
④ M为OH-;⑤ SnCl62-是氧化产物。
A.①③⑤ B.①②④⑤ C.①②③④ D.只有①③
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com