
题目列表(包括答案和解析)
2.已知煤油的密度是0.8g·cm-3,试根据金属钠的保存方法和金属钠与水反应的现象推断金属钠的密度
A.小于0.8g·cm-3 B.大于1.0g·cm-3
C.介于0.8g·cm-3~1.0g·cm-3之间 D.无法推测
1.下列物质,从化学组成的角度看,属于纯净物的是
A.某物质经检验只含有一种元素 B.不含杂质的无色透明的食盐水
C.浓硫酸 D.0℃时的冰水混合物
11、(15分)实验室有甲、乙两瓶无色溶液,其中一瓶是稀盐酸,另一瓶是碳酸钠溶液。为测定甲、乙两瓶溶液的成分及物质的量浓度,进行以下实验:
实验一:取25mL甲溶液,向其中缓慢滴入乙溶液15mL,共收集到224mL(标准状况)气体。
实验二:取15mL乙溶液,向其中缓慢滴入甲溶液25mL,共收集到112mL(标准状况)气体。
(1)判断:甲是 溶液,乙是 溶液;
(2)实验二中所发生反应的离子方程式为: ;
(3)甲溶液的物质的量浓度为 ,乙溶液的物质的量浓度为 ;
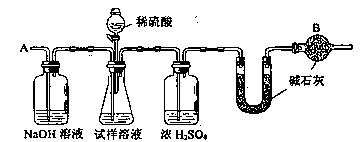 12、(15分)已知某纯碱试样中含有NaCl杂质,为测定试样中纯碱的质量分数,可用右图中的装置进行实验。
12、(15分)已知某纯碱试样中含有NaCl杂质,为测定试样中纯碱的质量分数,可用右图中的装置进行实验。
主要实验步骤如下:
① 按图组装仪器,并检验装置的气密性
② 将a g试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液
③ 称量盛有碱石灰的U型管的质量,得到b g
④ 从分液漏斗滴入6mol·L-1的硫酸,直到不再产生气体时为止
⑤ 从导管A处缓缓鼓入一定量的空气
⑥ 再次称量盛有碱石灰的U型管的质量,得到c g
⑦ 重复步骤⑤和⑥的操作,直到U型管的质量基本不变,为d g
请填空和回答问题:
⑴装置中干燥管B的作用是___________________________________________。
⑵如果将分液漏斗中的硫酸换成浓度相同的盐酸,测试的结果____________(填偏高、偏低或不变)。
⑶步骤⑤的目的是__________________________________________。
⑷步骤⑦的目的是__________________________________________。
⑸试样中纯碱的质量分数的计算式为___________________。
⑹还可以用其它实验方法测定试样中纯碱的质量分数。请简述一种不同的实验方法。
。
10、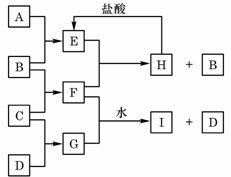 (15分)A、B、C、D是按原子序数由小到大排列的第二、三周期元素的单质。B、E均为组成空气的成分。F的焰色反应呈黄色。在G中,非金属元素与金属元素的原子个数比为1∶2。在一定条件下,各物质之间的相互转化关系如右(图中部分产物未列出)。请填写下列空白:
(15分)A、B、C、D是按原子序数由小到大排列的第二、三周期元素的单质。B、E均为组成空气的成分。F的焰色反应呈黄色。在G中,非金属元素与金属元素的原子个数比为1∶2。在一定条件下,各物质之间的相互转化关系如右(图中部分产物未列出)。请填写下列空白:
(1)A是 ,C是 。
(2)H与盐酸反应生成E的化学方程式是: 。
(3)E与F反应的化学方程式是: 。
(4)F与G的水溶液反应生成I和D的离子方程式是: 。
9、(15分)(1)往碳酸氢钠稀溶液中滴入氯化钙溶液,无沉淀产生,其原因是
;若往上述混合溶液中加入氢氧化钠溶液,可观察到
,其离子方程式为 ;
(2)在纯碱溶液中滴入酚酞,溶液变红。若在该溶液中再滴入过量的氯化钡溶液,所观察到的现象是 ,其原因是(以离子方程式和简要文字说明):
。
8、事实上,许多非金属氧化物在一定条件下能与Na2O2反应,且反应极有规律,如
Na2O2+SO2==Na2SO4,2Na2O2+2SO3==2Na2SO4+O2↑,据此,你认为下列反应方程式中正确的组合是:
①2Na2O2+2Mn2O7 ==4NaMnO4+O2↑ ②Na2O2+2NO2==2NaNO2+O2
③2Na2O2+2N2O3==4NaNO2+O2 ④2Na2O2+2N2O5==4NaNO3+O2
A、①② B、②③ C、①④ D、③④
高三化学复习单元测试-碱金属
班 学号 姓名
第I卷答题表
第Ⅱ卷(非选择题共60分)
7、有一在空气中暴露过的KOH固体,经分析知其内含水7.62%、K2CO3 2.38%,KOH 90%,若将样品1g加入到1mol·L-1盐酸46mL里,过量的酸再用1.07mol·L-1 KOH溶液中和,蒸发中和后的溶液可得固体质量为:
A、3.43g B、4.00g C、4.50g D、无法计算
6、由钾和氧组成的某种离子晶体中,阳离子和阴离子的质量之比为13∶8,其中阴离子只有过氧离子(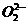 )和超氧离子(
)和超氧离子(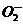 )两种。在此晶体中过氧离子与超氧离子的物质的量之比为:
)两种。在此晶体中过氧离子与超氧离子的物质的量之比为:
A、2∶1 B、1∶2 C、1∶1 D、1∶3
5、在甲、乙、丙、丁四个烧杯内放入0.1mol的钠、氧化钠、过氧化钠和氢氧化钠,然后各加入100mL水,搅拌,使固体完全溶解,则甲、乙、丙、丁所得溶液里溶质的质量分数大小的顺序是:
A、甲<乙<丙<丁 B、甲=丁<乙=丙
C、丁<甲<乙=丙 D、丁<甲<乙<丙
4、①钾比水轻; ②钾的熔点较低; ③钾与水反应时要放出热量; ④钾与水反应后溶液呈碱性。某学生将一小块金属钾投入滴有酚酞试液的水中,以上实验能证明上述四点性质中的:
A、①②③④ B、①②④ C、①③④ D、①④
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com