
题目列表(包括答案和解析)
4.下列除去杂质的方法正确的
A.除去N2中的少量O2:通过灼热的CuO粉末,收集气体
B.除去CO2中的少量HCl气体:通入饱和Na2CO3溶液,收集气体
C.除去FeCl2溶液中的少量FeCl3:加入足量铁屑,充分反应后,过滤
D.除去KCl溶液中的少量MgCl2:加入适量NaOH溶液,过滤
3.将某溶液逐滴加入Fe(OH)3溶胶中,开始时产生沉淀,继续滴加沉淀又溶解,该溶液是
A.2 mol·L-1 HCl溶液 B.2 mol·L-1 NaOH溶液
C.2 mol·L-1 MgSO4溶液 D.硅酸溶液
2.下列离子化合物中阳离子半径和阴离子半径之比最大的是
A. LiI B.NaBr C. KCl D. CsF
1.下列做法不利于改善环境的是
A.焚烧农作物秸秆 B.提倡使用农家肥
C.用H2作还原剂冶炼金属 D.限制燃油汽车数量的增加
26.(12分)一包重41.6 g的固体样品,其成分是硫和铁的化合物,将它充分煅烧后,硫和铁分别被氧化成SO2和Fe2O3,其中SO2在标准状况下为13.44 L。试求:
(1)样品中硫元素与铁元素的物质的量之比。
(2)样品化合物的成分是什么?
(3)样品中化合物的物质的量各为多少?
2006届高三十二月教学情况调查
25.(6分)某高分子化合物的单体A含硅、碳、氢及一种卤素。①其标况下的蒸气密度为5.76g/L。②取12.9g该有机物溶于水,过滤除去沉淀后,加水配成100mL溶液,取10mL溶液加入足量硝酸银,产生白色沉淀,该沉淀不溶于稀硝酸,经称量,质量为2.87g。③将12.9g的A在足量氧气中灼烧,产生卤化氢、二氧化碳、水和一种白色固体。将所得卤化氢、二氧化碳、水蒸气先后通过足量的饱和碳酸氢钠溶液、浓硫酸和碱石灰,碱石灰增重17.6g。
(1)该有机物的摩尔质量
(2)该有机物的分子式
24.(10分)有机物A(C8H8O2)为一种无色液体。从A出发可发生如下一系列反应
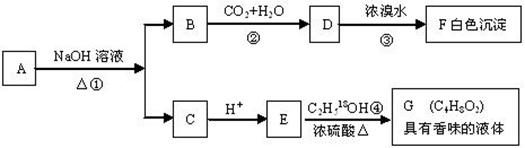
请回答:
(1)A和F的结构简式:A , F 。
(2)反应②的离子反应方程式: 。
反应④的化学反应方程式: 。(请注明示踪18O原子)
(3)A的同分异构体甚多,其中属于羧酸类的化合物,且含有苯环结构的异构体有多种。写出其结构简式
23.(10分)如图中C至L分别表示反应中的一种常见物质,E、F、I在通常情况下是气体单质,其中E有刺激性气体,X、Y是常见的金属单质.W是由甲、乙两种元素按1∶1组成,其中甲元素的原子M层电子数是K层的一半.乙元素的原子最外层电子数是次外层电子数的3倍,参加反应的水和生成的水已从图中略去.
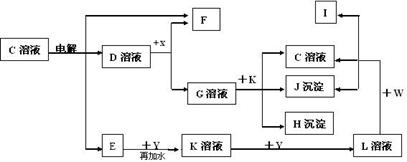
填写下列空白:
(1)E是________(化学式),X元素在周期表中的位置是 。
(2)写出W的电子式________________________________________ _ _。
(3)写出K+G→H+J+C的离子方程式______________________________________。
(4)设计实验分离H和J(写出加入试剂和操作方法):____________________ __。
22.(11分)(1)周期表中前20号元素中有A、B、C、D、E五种元素。已知它们都不是稀有气体元素,且原子半径依次减小,其中A和E同族,A与C、B与E原子的电子层数都相差2。A、B原子最外层电子数之比为1∶4。A和C能以原子个 数比1∶1形成化合物。
①写出元素符号 A B D E
②B与D形成的化合物是 分子(填极性、非极性)。
③用电子式表示A和D形成化合物过程
(2) 1183 K以下纯铁晶体的基本结构单元如图1所示,1183 K以上转变为图2所示结构的基本结构单元,在两种晶体中最邻近的铁原子间距离相同。
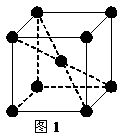
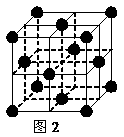
①在1183 K以下的纯铁晶体中,与铁原子等距离且最近的铁原子数为_______个;在1183 K以上的纯铁晶体中,与铁原子等距离且最近的铁原子数为___________;
②纯铁晶体在晶型转变前后,二者基本结构单元的边长之比为(1183 K以下与1183 K以上之比)___________。
③转变温度前后两者的密度比(1183 K以下与1183 K以上之比)_____________。
21.(8分)我国是最早记载丹砂的药用价值和炼制方法的,为了使人们重视丹砂,1982年我国发行面值为10分的丹砂邮票。汞单质和化合物在工业生产和科学研究上有其广泛用途。丹砂炼汞的反应包括以下两个反应:
 反应Ⅰ HgS +O2 Hg +SO2
反应Ⅰ HgS +O2 Hg +SO2
 反应Ⅱ 4HgS
+4CaO 4Hg +3CaS + CaSO4
反应Ⅱ 4HgS
+4CaO 4Hg +3CaS + CaSO4
请试完成下列:
①HgS与氧气反应,氧化剂是 。
②请标出反应Ⅱ中电子转移的方向和数目。
③得到的汞中含有铜等杂质,工业上常用5%的硝酸洗涤,写出除去少量铜杂质反应的离子方程式: 。
④已知Hg(NO3)2溶液中加入Hg,存在如下平衡:Hg + Hg2+
 Hg22+ ,提高Hg22+浓度的方法是:
。
Hg22+ ,提高Hg22+浓度的方法是:
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com