
题目列表(包括答案和解析)
2.下列各组物理量中,都不随取水量的变化而变化的是 ( )
A.水的沸点;蒸发水所需热量
B.水的密度;水中通入足量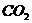 后溶液的pH值
后溶液的pH值
C.水的体积;电解水所消耗的电量
D.水的物质的量;水的摩尔质量
1.摩尔是 ( )
A.国际单位制的一个基本物理量 B.表示物质质量的单位
C.计量微观粒子的物质的量的单位 D.表示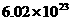 个粒子的集体
个粒子的集体
25、(10分)Cu、CuO、Cu2O组成的混合物,加入100mL0.6mol/LHNO3溶液恰好使混合物完全溶解,同时收集到224mLNO气体(标准状况).回答下列问题:
(1)写出Cu2O跟稀硝酸反应的化学方程式______________________________________
(2)产物中硝酸铜的物质的量为____________mol
(3)如混合物中含0.01molCu,则其中Cu2O、CuO的物质的量分别为____________mol、__________________mol。
(4)如混合物中Cu的物质的量为X,其中CuO的物质的量为_____________________(用含X的代数式表示)
湖南省示范性中学07届高三化学百校联考试题
24、(6分)某燃料电池以熔融的Na2CO3(其中不含O2-和HCO3-)为电解质,以丁烷为燃料,以空气为氧化剂,以具有催化作用和导电性能的稀土金属材料为电极。该燃料电池的电极反应为:正极:26CO2+13O2+52e- =26CO32-;负极:2C4H10+26CO32--52e- = 34CO2+10H2O
(1)写出该燃料电池总的化学反应方程式_________________________________
(2)为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定。为此,必须在正极通入的空气中加入一种物质,其加入的物质是(写化学式)______________;它从哪里来?从________________来。
23、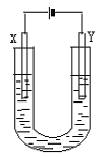 (10分)右图是用石墨和铁作电极电解饱和食盐水的装置。请填空:
(10分)右图是用石墨和铁作电极电解饱和食盐水的装置。请填空:
(1)Y的电极材料为铁,所发生的电极反应为________________________
检验X极产物的方法是___________________________________
(2)某同学在实验时误将两种材料接反,导致X极上未得到预期产物。一段时间后该同学发现U型管中出现白色沉淀,此沉淀是__________________(填化学式);其形成原因是_________________________;该沉淀在空气中放置,现象是___________________________。
22、(6分)物质X是中学化学中的常见物质,X既能与稀硫酸反应,又能与氢氧化钠溶液反应。
(1)若X为氧化物,X的化学式为_______________________
(2)若X为单质,X用于焊接钢轨反应的化学方程式为__________________________
(3)若X与稀硫酸反应生成一种无色无味的气体A,与浓氢氧化钠溶液在加热条件下反应生成一种无色有刺激性气味的气体B,等物质的量的气体A和气体B在水溶液中反应又生成X。则X与足量稀氢氧化钠溶液反应的离子方程式是____________________________。
21、(8分)下图是部分短周期元素的单质熔点的变化图:根据此图,填写下列空白:
(1)图中⑦号元素位于周期表第_____________周期,第____________族
(2)图中⑥号元素的最高价氧化物对应的水化物呈两性,该化合物与氢氧化钠溶液反应的离子方程式为____________________________________________
(3)图中③号与⑧号能形成分子式为XY2型的化合物,用电子式表示该化合物的形成过程___________________________________________________
(4)⑦号元素与氧元素形成的化合物其晶体属于____________,若要使其熔化,需破坏的作用力是____________________________
20、(8分)要配制500mL0.2mol/L的FeSO4溶液,实验步骤有:①在天平上称取ag绿矾(FeSO4·7H2O),将它放在烧杯中,用适量蒸馏水使其完全溶解;②将所得溶液沿玻璃棒注入500mL容量瓶中;③继续向容量瓶中加水至液面距刻度线1-2cm处,改用胶头滴管加蒸馏水至液面凹面最低处与刻度线相平;④用少量水洗涤烧杯和玻璃棒2-3次,每次洗液都转入容量瓶;⑤将容量瓶塞紧,充分摇匀。填写下列空白:
(1)ag绿矾的实际质量是___________;
(2)上述操作步骤的正确顺序为_____________________;
(3)若配制时遗漏步骤④,会使所配溶液的浓度_________(填“偏高”、“偏低”、“无影响”);(4)若定容时加蒸馏水不慎超过刻度线,处理方法是______________________________。
19、请按要求填空:(6分)
(1)用______________(填仪器名称)量取16.50mL1mol/L的KOH溶液.
(2)用______________(填试剂名称)来洗涤做银镜反应后的试管。
(3)硫酸铜晶体结晶水含量的测定实验,包括研磨、加热、称量等操作步骤,其中判断硫酸铜晶体完全失水的定性实验现象是________________,完成测定实验过程至少要进行_________次称量操作。
18、在一接近中性的含Na+的澄清溶液中,可能还存在NH4+、Fe2+、I-、Br-、CO32-、SO32-六种离子中的几种。(1)在原溶液中滴加足量的饱和氯水后,有气泡产生;溶液呈橙黄色;(2)向呈橙黄色溶液中加入BCl2溶液时无沉淀生成;(3)橙黄色溶液不能使淀粉变蓝色。根据上述事实推断,该溶液中肯定不存在的离子组是( )
A、NH4+、Br-、CO32- B、Fe2+、I-、SO32- C、NH4+、Br-、SO32- D、Fe2+、I-、CO32-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com