
题目列表(包括答案和解析)
14.在一个固定体积的密闭容器中加入2mol A,发生可逆反应:2A(g) 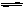 2B(g)+C(g)。该反应达到平衡的标志是( )
2B(g)+C(g)。该反应达到平衡的标志是( )
A.容器内压强是开始时的1.5倍 B.容器内A、B、C物质的量浓度之比为2∶2∶1
C.单位时间消耗0.2molA同时生成0.1molC D.容器内各物质的浓度不随时间变化
13.下列实验中,由于错误操作导致所测出的数据一定偏低的是( )
A.用量筒量取一定体积液体时,俯视读出的读数
B.用标准盐酸滴定未知浓度的NaOH溶液,酸式滴定管未用标准盐酸溶液润洗,所测出的碱液的浓度值
C.测定硫酸铜晶体中结晶水含量时,加热温度太高使一部分硫酸铜发生分解,所测出的结晶水的含量
D.做中和热测定实验时,在大小烧杯之间没有垫碎泡沫塑料(或纸条),所测出的中和热的数值
12.pH=2的两种一元酸HX和HY分别与足量锌粉反应,所生成的H2体积 V(HX)>V(HY)。下列说法正确的是( )
A.这两种酸的物质的量浓度一定相同而体积不同 B.酸的物质的量浓度 c (HX)一定大于c (HY)
C.若两种酸体积相同,则HY的酸性比HX酸性强 D.HY一定不是弱酸
11.溶质为11.2g的KOH稀溶液与0.1L 1.0mol•L-1的H2SO4溶液反应可放出11.46kJ的热量。下列能表示中和热的热化学方程式为( )
A.KOH(aq)+1/2 H2SO4(aq)=1/2 K2SO4+H2O(l);ΔH=-11.46 kJ•mol-1
B.2KOH(aq)+ H2SO4(aq)= K2SO4+2H2O(l);ΔH=-114.6 kJ•mol-1
C.2KOH(aq)+ H2SO4(aq)= K2SO4+2H2O(l);ΔH= +114.6 kJ•mol-1
D.KOH(aq)+1/2 H2SO4(aq)=1/2 K2SO4+H2O(l);ΔH=-57.3 kJ•mol-1
10.下列各组离子因发生氧化还原反应而不能大量共存的是( )
A.H+、Fe2+、NO3-、Cl- B.K+、Fe3+、NO3-、SCN-
C.Al3+、Na+、Cl-、AlO2- D.Ca2+、NH4+、SO42-、OH-
9. 铅蓄电池反应如下:
铅蓄电池反应如下: 对铅蓄电池工作情况,下列叙述错误的是( )
对铅蓄电池工作情况,下列叙述错误的是( )
A.放电时Pb极为负极
B.充电时蓄电池上标有“+”号电极连接电源正极
C.放电时正极反应为PbO2+ SO42- +4H++2e ==PbSO4+2H2O
D.充电时蓄电池上标有“-”号的电极发生氧化反应
8.Rm+与Xn-具有相同的电子层结构,则微粒半径
A.前者大于后者 B.前者小于后者 C.前者等于后者 D.大小比较不能确定
7.下列变化中证明硫酸是强酸的是( )
A.和铜反应 B.和锌反应放出H2
C.与NaCl反应制HCl D.与Ca3(PO4)2反应制H3PO4
6. 将一空心铁球放入盛有密度为 ρ g/cm3的饱和食盐水的烧杯中,铁球所处位
将一空心铁球放入盛有密度为 ρ g/cm3的饱和食盐水的烧杯中,铁球所处位
置如右图所示。将下列物质分别加入烧杯中,能使铁球上浮的是( )
A.食盐晶体 B.酒精
C.密度为ρ g/cm3的稀硫酸 D.密度为ρ g/cm3的CuSO4溶液
4.有几种试验事故处理方法:① 镁着火使用二氧化碳扑灭。② 不慎将浓硫酸沾到皮肤上,
应迅速用布擦去,再用水冲洗,再涂上稀小苏打溶液。③ 苯酚洒到皮肤上用碳酸氢钠溶液洗。④ 误食铜盐后,喝生牛奶或蛋清。其中正确的是( )
A.① B.④ C.②④ D.②③
5下列制取硫酸铜的实验设计能体现“经济、高效、环保”精神的是( )
A.铜与浓硫酸共热
B.用铜片为阳极,石墨为阴极,电解稀硫酸
C.先灼烧废铜屑生成氧化铜,然后再用浓硫酸溶解
D.适当温度下,使铜片在持续通入空气的稀硫酸中溶解
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com