
题目列表(包括答案和解析)
7.相同状况下,在容积相同的三个烧瓶内,分别充满干燥的NH3、HCl、NO2气体.然后分别做喷泉实验,实验结束后,烧瓶内3种溶液的物质的量浓度之比为 ( )
A.3:3:2: B.1:1:1: C.2:2:3: D.无法比较
6.下列说法正确的是(N表示阿伏加德罗常数的值) ( )
A.28g氮气所含有的原子数目为N B.4g金属钙变成钙离子时失去的电子数目为0.1N
C. 1mol甲烷的质量与N个甲烷分子的质量之和相等
D.标准状况下,22.4L甲烷和乙炔混合物所含的分子数为N
5.对于氯化铁溶液和氢氧化铁胶体,以下说法正确的是( )
A.分散质粒子直径都在1nm-100nm之间
B.分散质微粒都能透过半透膜
C.加热蒸干并灼烧后都有氧化铁生成
D.分散系中分散质微粒前者带电荷、后者不带电荷
4.X2气体和Y2气体共100mL,通过光照使它们充分反应,恢复到原状况时发现体积仍是100mL,下列说法正确的是( )
A.X2气体过量 B。X2和Y2的体积均为50mL
C.产物是双原子分子 D。无法确定两气体的体积比
3.能正确表示下列反应的离子方程式是( )
A.甲酸钠溶液和盐酸反应:HCOO-+H+=HCOOH
B.硫化钠的第一步水解:S2-+2H2O H2S+2OH-
H2S+2OH-
C.醋酸钡溶液和硫酸反应:Ba2++SO =BaSO4↓
=BaSO4↓
D.氢氧化钙溶液和碳酸氢镁反应: Ca2++OH-+HCO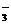 =CaCO3↓+H2O
=CaCO3↓+H2O
2.将V1mL1.0mol/L HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如右图所示(实验中始终保持V1+V2=50mL)。下列叙述正确的是

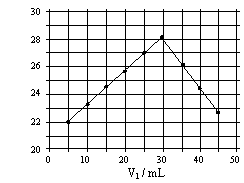 A 做该实验时环境温度为22℃
A 做该实验时环境温度为22℃
B 该实验表明化学能可能转化为热能
C NaOH溶液的浓度约为1.0mol/L
D 该实验表明有水生成的反应都是放热反应
1.已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ.且氧气中1 mol O=O键完全断裂时吸收热量496 KJ,水蒸气中1 mol H-O键形成时放出热量463 KJ,则氢气中1 mol H-H键断裂时吸收热量为
A.920 kJ B.557 kJ C. 436 kJ D.188 kJ
28.(7分)某硫酸厂在进行黄铁矿(主要成分是FeS2)成分测定时,取0.1000g样品在空气中充分灼烧,将生成的SO2气体与足量Fe2(SO4)3溶液完全反应,用浓度为0.02000mol/L的K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液25.00mL。
已知:①SO2+2Fe2++2H2O=SO2- 4+2Fe3++4H+
②___ Cr2O2- 7+___ Fe2++___ H+=___ Cr3++____ Fe3++_____ H2O
⑴在反应②的横线上填写相应的化学计量数。
⑵若灼烧6g FeS2产生的SO2全部转化为SO3气体时放出9.83kJ热量,写出SO2气体转化为SO3的热化学方程式:____________________________________________________。
⑶求样品中的质量分数(假设杂质不参加反应),写出计算过程。
27.(4分)250℃时将24.8gNaOH和NaHCO3的混合物放在密闭容器中加热,充分反应后,称得剩余固体的质量为23g。请回答:
⑴NaOH和NaHCO3的物质的量之比为______1(填>、<或=)。
⑵NaOH的物质的量为_______________。
26.(13分)Ⅰ.硫酸的消费量常被作为有关国家工业发达水平的一种标志,下表为接触法制硫酸时,温度和压强对SO2转化率的影响:
|
压强/MPa 温度/℃ |
0.1 |
0.5 |
1 |
10 |
|
400 |
99.2 |
99.6 |
99.7 |
99.9 |
|
500 |
93.5 |
96.9 |
97.8 |
99.3 |
|
600 |
73.7 |
85.8 |
89.5 |
96.4 |
⑴硫酸工业在国民经济中占有重要的地位,请写出它的两种重要用途:
___________________、_____________________。
⑵工业中催化氧化SO2采用常压而不用高压,理由是___________________________________
_______________________________________。
Ⅱ.实验室中,用如下图所示装置及所给药品(图中部分夹持仪器已略去)探究工业制硫酸接触室中的反应,并收集得到SO3。已知SO3熔点为16.8℃,沸点44.8℃,且SO3遇水剧烈反应。
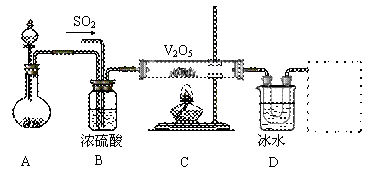
⑴写出A装置中制取氧气的化学方程式__________________________________。
⑵B装置的作用除了将气体充分混合外,还有:
①________________________________,②_________________________________。
⑶加热硬质玻璃管时,若不断升高温度,对SO2和O2生成SO3的化学反应有何影响:
_____________________________________________________________。
⑷本实验装置虚框处还需接一装置,甲、乙、丙三同学分别设计了a、b、c三套装置,你认为不合理的是________,理由是______________________________________。

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com