
题目列表(包括答案和解析)
11. 密度为0.91g/cm3的氨水,质量分数为25%,该氨水用等体积水稀释后,所得溶液的质量分数为
A. 等于12.5% B. 小于12.5% C. 大于12.5% D. 无法确定
10.pH相同的醋酸溶液和盐酸,分别用蒸馏水稀释到原溶液的m倍和n倍,稀释后两溶液的pH仍相同,则m和n的关系是
A. m=n B. m>n C. m<n D. 无法判断
9. 在10mL 0.1mol·L-1NaOH溶液中加入同体积、同浓度的HAc溶液,反应后溶液中各微粒的浓度关系错误的是 ( )
A.c(Na+)>c(Ac-)>c(H+)>c(OH-) B.c(Na+)>c(Ac-)>c(OH-)>c(H+)
C.c(Na+)=c(Ac-)+c(HAc) D.c(Na+)+c(H+)=c(Ac-)+c(OH-)
8. 下列指定微粒的个数比为2:1的是
A. BaO2(过氧化钡)固体中的阴离子和阳离子 B. 12H原子中的中子和质子
C. NaHCO3晶体中的阳离子和阴离子 D. Be2+离子中的质子和电子
7.在以下电解池中,随着电解的进行,电解池中溶液的pH值会减小的是 ( )
A.铜为阳极、铜为阴极,电解液为CuSO4溶液
B.石墨为阳极、铁为阴极,电解液为CuSO4溶液
C.银为阳极,铜为阴极,电解液为AgNO3溶液
D.石墨为阳极,铁为阴极,电解液为NaCl溶液
6.为了确定SbCl3、SbCl5、SnCl4是否为离子化合物,可以进行下列实验。其中合理、可靠的是
A. 观察常温下的状态。SbCl5是苍黄色液体,SnCl4为无色液体。结论:SbCl5和SnCl4都是离子化合物
B. 测定SbCl3、SbCl5、SnCl4的熔点依次为73.5 ℃、2.8 ℃、-33 ℃。结论:SbCl3、SbCl5、SnCl4都不是离子化合物
C. 将SbCl3、SbCl5、SnCl4溶解于水中,滴入HNO3酸化的AgNO3溶液,产生白色沉淀。结论: SbCl3、SbCl5、SnCl4都是离子化合物
D. 测定SbCl3、SbCl5、SnCl4的水溶液,发现它们都可以导电。结论:SbCl3、SbCl5、SnCl4都是离子化合物
5.以NA表示阿弗加德罗常数,下列说法中正确的是 ( )
A.53g碳酸钠中含NA个CO32- B.0.1molOH-含NA个电子
C.1.8g重水(D2O)中含NA个中子 D.标准状况下11.2L臭氧中含NA个氧原子
4.已知某溶液中存在较多的H+、SO42--、NO3--,则该溶液中还可能大量存在的离子组是
A.Al3+、CH3COO--、Cl-- B.Mg2+、Ba2+、Br-
C.Fe2+、Cl--、I-- D. Na+、NH4+、Cl-
3. 下列物质中不会因见光而分解的是
A. NaHCO3 B. HNO3 C. AgI D.HClO
2. 下列电子式中书写正确的是
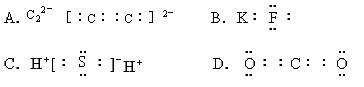
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com