
题目列表(包括答案和解析)
33.(6分)科学家从化肥厂生产的(NH4)2SO4中检出组成N4H4(SO4)2的物质,经测定,该物质易溶于水,在水中以SO42-和N4H44+两种离子形式存在,植物的根系极易吸收N4H4+4,但它遇到碱时,会生成一种类似白磷的N4分子,N4分子不能被植物吸收。
请回答下列问题:
(1)N4和N2的关系正确的是___________(填序号);
A.同种单质 B.同位素 C.同分异构体 D.同素异形体
(2)N4H4(SO4)2______ (填“能”或“不能”)和草木灰混合施用;
(3)已知白磷、NH4+、N4H44+的空间构型均为四面体,NH4+的结构式为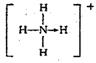 (→表示共用电子对由N原子单方面提供),白磷(P4)的结构式为
(→表示共用电子对由N原子单方面提供),白磷(P4)的结构式为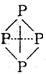 。
。
请画出N4H44+的结构式_____________________。
(4)已知液氨中存在着平衡2NH3 NH4++NH2-。科学家在液氨中加入氢氧化铯(CsOH)和特殊的吸水剂,使液氨中的NH4+生成N4分子,请写出液氨与氢氧化铯反应的化学方程式:______________
NH4++NH2-。科学家在液氨中加入氢氧化铯(CsOH)和特殊的吸水剂,使液氨中的NH4+生成N4分子,请写出液氨与氢氧化铯反应的化学方程式:______________
32.(11分)A、B、D是三种常见的短周期元素,它们的原子序数逐渐增大,B元素原子最外层电子数3个,是D元素原子最外层电子数的一半,A元素原子最外层电子数比B多一个。甲、乙、丙是三种最高价含氧酸的钠盐,甲中含B元素,乙中含D元素,丙中含A元素,甲、丙的水溶液均有较强的碱性,乙的水溶液pH小于7。丁为一种气体,戊为淡黄色固体。甲、乙、丙、丁、戊、已六种物质之间的相互反应关系如下图:(图中略去了物质转化时的部分生成物)
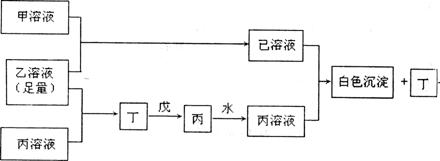
回答下列问题:
(1)写出A、B、D三种元素的元素名称 、 、 。
(2)写出戊的电子式 。
(3)用电子式表示化合物AD2的过程 。
(4)若乙溶液不足量,乙溶液分别和甲、丙溶液也能发生化学反应,但生成物不是已和丁,写出不足量的乙溶液分别和甲溶液、丙溶液反应时的离子反应方程式:
乙+甲 ;
乙+丙 。
31.(7分)含氮废水进入水体而对环境造成的污染越来越严重。某校环保小组的同学认为可以用金属铝将水中的NO3-还原为N2,从而消除污染。
(1)配平下面离子反应方程式: NO3-+ Al+ H2O -- N2↑+ Al(OH)3 + OH-
(2)以上反应中每生成1 mol这种还原产物,将有__________摩尔电子发生转移。
(3)环保小组治理方案是否合理___________,理由是 。
30、某温度下,体积一定的密闭容器中进行如下可逆反应:
 X(g)+Y(g) Z(g)+W(s);△H<0下列叙述正确的是 ( )
X(g)+Y(g) Z(g)+W(s);△H<0下列叙述正确的是 ( )
A.增加少量W,正反应速率减小 B. 当容器中气体的密度不变时,反应达到平衡
C.降低温度 ,平衡不移动 D.平衡后加入Z ,上述反应的△H减小
29、已知原子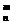 X,则下列论断正确的是( )
X,则下列论断正确的是( )
A.这种元素的近似原子量为m B。这种元素的原子量为m+n
C.该原子核内的中子数为n-m D。不能由此确定元素X的原子量
28.已知浓硫酸的密度比稀硫酸大,现将质量分数为90%和10%二种硫酸溶液等体积混合后溶质的质量分数为 ( )
A.大于50% B.等于50% C.小于50% D.无法确定
27.检验SO2气体中是否混有CO2气体,可采用的方法是( )
A. 通过品红溶液 B. 通过澄清石灰水
C. 先通过NaOH溶液,再通过澄清石灰水
D. 先通过酸性KMnO4,再通过澄清石灰水
25.随着卤原子半径增大,下列说法正确的是( ). (A)单质的熔沸点逐渐降低 (B)卤素离子的还原性逐渐增强 (C)气态氢化物稳定性逐渐增强 (D)单质氧化性逐渐增强 26.能说明氧的非金属性比硫强的事实是
A. 在通常状况下,氧单质是无色气体,而硫单质是淡黄色晶体
B.在通常状况下,水为液态,而硫化氢为气态
C.氢硫酸暴露于空气中会变浑浊
D.在SO2分子中S呈正价,O呈负价
24.某温度时,将Cl2通入NaOH溶液中,得到NaCl、NaClO、NaClO3混合液,经测定ClO3―与ClO―浓度之比为3:1,则Cl2与NaOH反应时被还原的氯原子与被氧化的氯原子的物质的量之比为
A.21:5 B.11:3 C.3:1 D.4:1
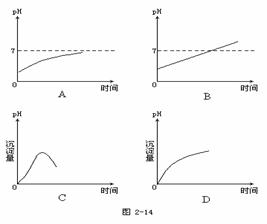
22.碱性电池具有容量大,放电电流大的特点,因而得到广泛应用.锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反为:Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2 (s)+Mn2O3(s)下列说法错误的是 ( ) A.电池工作时,锌失去电子 B.电池正极的电极反应式为2MnO2(s)+H2O(l)+2e- = Mn2O3(s)+2OH-(aq) C.电池工作时,电子由正极通过外电路流向负极 D.外电路中每通过0.2mol电子,锌的质量理论上减少6.5g 23.用石墨电极电解AlCl3溶液时,下列曲线合理的是见(图2-14) ( )
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com