
题目列表(包括答案和解析)
4.为了除去粗盐中Ca2+、Mg2+、SO42-及泥沙,将粗盐溶于水,然后进行下列操作:①过滤②加足量的NaOH溶液③加适量盐酸④加过量Na2CO3溶液⑤加过量BaCl2溶液,合理的操作顺序是
A.④⑤②①③ B.②⑤④③① C.⑤②④①③ D.①④②⑤③
3.下列化工生产过程中所发生的反应不属于氧化还原反应的是
A.用油脂制肥皂 B.用铝土矿制金属铝 C.用氯气和消石灰制漂白 D.用氢气和氮气合成氨
2.下列叙述正确的是
A.强电解质都是离子化合物,因此NaCl是离子化合物 B.醋酸溶液的导电能力可能比稀硫酸强
C.SO3溶于水,其水溶液能导电,SO3是电解质 D.硫磺是单质,不导电,因此硫磺是非电解质
1.生活中的问题常涉及化学知识,下列过程不涉及化学变化的是
A.用食醋或醋精除去暖瓶内的水垢 B.用四氯化碳擦去圆珠笔油渍
C.用糯米饭、酒曲等自制甜酒酿 D.用75%的乙醇溶液进行皮肤消毒
27、(12分)观察实验,根据实验现象回答问题。某学校元旦晚会上,主
持人用手枪式喷雾器向一张“白”纸喷出一种未知溶液,便在白纸上
出现“努力学习”四个黑字。这时主持人再向白纸喷出H2O2水雾,
结果黑色字迹消失,同时出现“迎接挑战”四个蓝色字体。(已知“努
力学习”四个字是事先用 Pb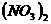 溶液写好的。)
溶液写好的。)
⑴第一次喷出的溶液一定含有 离子。
⑵喷出的H202使“努力学习”四个字隐去,同时又出现“迎接挑战”四个字,其原因是
;
⑶使“努力学习”四个黑字出现的有关反应的离子方程式是
⑷该过程中涉及的氧化还原反应的化学方程式是:
。
答案:S2- ;双氧水将硫化铅氧化成白色的硫酸铅,而事先纸上有淀粉和碘化钾
双氧水将I-氧化成I2; Pb2+ + S2- =PbS; PbS+4H2O2=PbSO4 +4H2O
2KI + H2O2 = 2KOH + I2
26、(8分)已知硫酸锰(MnSO4)和过硫酸钾( K2S2O8)两种盐溶液在
银离子催化下可发
生氧化还原反应,生成高锰酸钾、硫酸钾和硫酸。
⑴请写出并配平上述反应的化学方程式 ;
⑵此反应的还原剂是 ;它的氧化产物是 ;
⑶此反应的离子方程式 ;
⑷若该反应所用的硫酸锰改为氯化锰,当它跟过量的过硫酸钾反应
时,除有高锰酸钾、硫酸钾、硫酸生成外,其他的生成物还
有 。
答案:⑴2MnSO4 + 5K2S2O8 + 8H2O =4K2SO4 +2KMnO4+8H2SO4
⑵MnSO4 KMnO4
⑶参照方程式
⑷Cl2
25、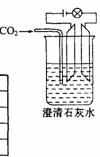 ( 8 分)已知 Ca
( 8 分)已知 Ca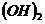 、 CaCO3和 Ca
、 CaCO3和 Ca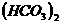 都是电解质,根据溶液的导电能力,实验装置如图,将实验现象填在下面的空格中。
都是电解质,根据溶液的导电能力,实验装置如图,将实验现象填在下面的空格中。
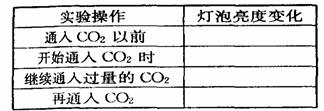
答案:亮;变暗直至几乎熄灭;变亮;不变
24、(6分)Cl2 和NH3 能发生下列反应:3Cl2+8NH3=6NH4Cl+N2 。
⑴该反应中氧化剂是 ,还原剂是 。被氧化的NH3 占
参加反应的NH3的 ;氧化剂与作还原剂物质的分子个数比
为
⑵若有6.8g NH3 参加了反应,则被氧化的NH3 为 g,生成
氧化产物 g。
答案:Cl2;NH3;25%;3:2;1.7;1.4
23、(14分)用如图所示装置(夹持仪器省略)进行实验,将液体A逐
滴加入到固体B 中,回答下列问题:
⑴图中D装置在实验中的作用是 .
⑵若 A为30%H2O2溶液,B为MnO2 ,C盛有氢硫酸(H2S)饱和溶
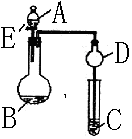 液,旋开E后,C中的现象为
,
液,旋开E后,C中的现象为
,
C中发生反应的化学方程式为 。
⑶若A为浓盐酸,B为KMnO4,C中盛有KI淀
粉溶液,旋开E后,C中的现象是 ;
继续通气体于C 中,足够长的时间后,发现C中
溶液的颜色消失,这 是因为在溶液中I2能被Cl2
氧化为HIO3,写出该反应的化学方程式 。
⑷若A为浓氨水,B为生石灰,C中盛有AlCl3溶液,旋开E,足够长
的时间后,C中的现象是 ,C中发生反应的离子方程式
为 。
⑸该题图示装置有多种用途,请举一例(除题中之外)填空:
A为 ,B为 ;C中盛 ,
其目的为 。
答案:(1)防止溶液倒吸
(2)溶液中出现淡黄色浑浊;2H2S+O2=2S↓+2H2O
(3)溶液由无色变蓝;5Cl2+I2+6H2O=2HIO3+10HCl
(4)产生白色胶状沉淀;Al3++3NH3·H2O=Al(OH)3↓+3NH+4(以
上方程式每空2分,其余每空1分)
(5)A中盛有浓硫酸、B中盛有Na2SO3、C中盛有品红溶液;检
验SO2能否使品红褪色。(每空1分)
22、(5分)已知多元弱酸在水溶液中的电离是分步进行的,且第一步
电离程度远大于第二步,第二步电离程度远大于第三步……,现有HA、
H2B、H3C三种一元、二元、三元酸,它们之间能发生如下反应:
HA + HC2-(少量)== A- + H2C-
2A- + H2B(少量)==2HA + B2-
H2C- + H2B(少量)==H3C + HB-
根据“较强酸 + 较弱酸盐 == 较弱酸 + 较强酸盐”的规律,回答下
列问题:
⑴在相同条件下,HA、H2B、H3C三种酸中酸性最强的是______ ______。
⑵A-、B2-、C3-、HB-、HC2-、H2C-六种离子中,最易结合质子(H+)的是
______________,最难结合质子(H+)的是______________。
⑶写出下列反应的离子方程式:
H3C + OH-(过量) == _______________________________________ 。
HA(过量) + C3- == _______________________________________。
答案:(①H2B ②C3+、HB- ③H3C+3OH-=C3-+3H2O 2HA+C3-=H2C-+2A-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com