
题目列表(包括答案和解析)
3. 6×105kJ能量,若反应:SO2(g) + 1/2O2(g)
SO3(g);△H=-98.3kJ·mol-1
6×105kJ能量,若反应:SO2(g) + 1/2O2(g)
SO3(g);△H=-98.3kJ·mol-1
放出的热量能在生产过程中得到充分利用,则每生产1t98%硫酸可向外界输出
kJ能量。
(3)若1g含SiO2和FeS2的某硫铁矿样品,在氧气中充分燃烧,残余固体质量为0.84g,
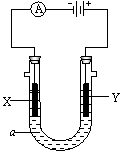 则这种矿石100t,可以制得98%的H2SO4质量为
t。
则这种矿石100t,可以制得98%的H2SO4质量为
t。
23.(11分)硫酸工业生产应考虑综合经济效益问题。
(1)若从下列四个城市中选择一处新建一座硫酸厂,你认为厂址宜选在 的
郊区(填选项的标号)。
A.有丰富黄铁矿资源的城市 B.风光秀丽的旅游城市
C.人口稠密的文化、商业中心城市 D.消耗硫酸甚多的工业城市
(2)据测算,接触法制硫酸过程中,若反应热都未被利用,则每生产1t 98%硫酸需消耗
22.(8分)下图中的每一方格表示有关的一种反应物或生成物,其中粗框表示初始反应物(反应
时加入或生成的水,以及生成沉淀J时的其他产物均已略去)。
请填写下列空白:
(1)物质B是 ,G是 ,J是 。(填化学式)
(2)反应①的离子方程式是
。
21.(10分) 中和热测定实验的关键是要比较准确地配制一定的物质的量浓度的溶液,量热器
要尽量做到绝热;在量热的过程中要尽量避免热量的散失,比较准确地测量出反应前后溶
液温度的变化。回答下列问题:
(1)中学化学实验中的中和热的测定所需的玻璃仪器除烧杯和温度计外还有:
;
(2)该实验常用0.50mol·L-1HCl和0.55mol·L-1的NaOH溶液各50mL。NaOH的浓度大于
HCl的浓度其原因是 。当室温低于10℃时进行,对实
验结果会造成较大的误差的主要原因是 。
(3)若上述HCl、NaOH溶液的密度都近似为1g/cm3,中和后生成的溶液的比热容
C=4.18J/(g·℃),则该中和反应放出热量为 kJ(填表达式),
ΔH= kJ/mol(填表达式)。
20.(6分)(1)室温下,将2g苯(C6H6)完全燃烧生成液态水和CO2,放出83.6kJ的热量,
写出C6H6燃烧热的热化学方程式 。
(2)若lg水蒸汽转化成液态水放热2.44kJ,则室温下1molC6H6完全燃烧生成气态水时放出
的热量为 。
19.(4分)配平氧化还原反应方程式,
(1) NH3+ NO2→ N2+ H2O
(2)氧化产物与还原产物的质量比为 。
18.(6分)在陶瓷工业上常遇到因陶土里混有氧化铁而影响产品质量的情况,解决的方法是将
陶土和水一起搅拌,使微粒直径处于10-9-10-7m之间,然后插入两根电极,接通直流电源,
这时阳极聚集 ,阴极聚集 ,理由
是 。
17.(4分)有下列几种晶体:①冰;②金刚石;③氯化钠;④干冰;,其熔点由低到高的顺序
是(填序号) 。
16.多硫化钠Na2Sx(X≥2)在结构上与Na2O2,FeS2等有相似之处,Na2Sx在碱性溶液中可被NaClO氧化成Na2SO4,而NaClO被还原为NaCl反应中,Na2Sx与NaClO的物质的量之比为1:16,则X值是
A.2 B.3 C.4 D.5
第I卷答题卡(选择题共48分)

 第II卷(非选择题共62分)
第II卷(非选择题共62分)
15.接触法制硫酸生产过程中,假如进入接触室的原料气为100m3,反应后体积减少为92m3,
已知原料气中SO2、O2、N2的体积比为20:15:65,则SO2的转化率为
A.60% B.70% C.80% D.90%
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com