
题目列表(包括答案和解析)
9、向含有Br2和BaCl2的酸性溶液中通入SO2气体,有沉淀生成,此沉淀是
A.BaSO4 B.BaS C.BaSO3 D.S
8、如图示的装置中,把X溶液逐滴滴下与Y物质反应,若X
为浓硫酸,Y为第三周期金属元素中常温下与水难反应的单
质。Z为品红溶液。实验中观察到Z褪色。则Y为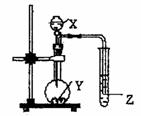
A.Na B.Mg C.Al D.Mg或Al
7、下列叙述正确的是
A、48gO3气体含有6.02×1023个O3分子
B、5.6g Fe与足量的稀盐酸反应发生电子0.3 mol
C、0.5mol·L-1CuCl2溶液中含有3.01×1023个Cu2+
D、标准状况下,33.6LH2O含有9.03×1023个H2O分子
6、1 g氢气燃烧生成液态水放出142.9 kJ热,表示该反应的热化学方程式正确的是
A.2H2(g)+O2(g)====2H2O(l);ΔH=-142.9 kJ·mol-1
B.2H2(g)+O2(g)====2H2O(l);ΔH=-571.6 kJ·mol-1
C.2H2+O2====2H2O;ΔH=-571.6 kJ·mol-1
D.2H2(g)+O2(g)====2H2O(l);ΔH=+571.6 kJ·mol-1
5、下列化学反应的离子方程式正确的是
A、用小苏打治疗胃酸过多: HCO3- + H+ == CO2↑+ H2O
B、往碳酸镁中滴加稀盐酸: CO32- + 2H+ == CO2↑+ H2O
C、往氨水中滴加氯化铝: Al3+ + 4OH- == AlO2- + 2H2O
D、氢氧化钡溶液与稀硫酸反应: Ba2+ + SO42- + H+ + OH- == BaSO4↓+ H2O
4、2008年北京奥运会主体育场--“鸟巢”,被《泰晤士报》评为全球 “最强悍”工程。 “鸟巢”运用了高强度、高性能的钒氮合金高新钢和884块ETFE膜,并采用新一代的氮化镓高亮度LED材料。有关说法正确的是
A.合金的熔点通常比组分金属高,硬度比组分金属小
 B.已知Ga处于ⅢA主族,可推知氮化镓化学式为Ga3N2
B.已知Ga处于ⅢA主族,可推知氮化镓化学式为Ga3N2
C.用金属铝与V2O5冶炼钒,铝作还原剂
D.ETFE膜(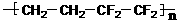 )是由两种单体缩聚而成的
)是由两种单体缩聚而成的
3、氯气是一种重要的工业原料。工业上利用反应在3Cl2 + 2NH3 = N2 + 6HCl检查氯气管道是否漏气。下列说法错误的是
A、若管道漏气遇氨就会产生白烟; B、该反应利用了Cl2的强氧化性
C、该反应属于复分解反应; D、生成1molN2有6mol电子转移
2、如果用排水法收集浓硝酸受热分解所产生的气体,则
A.收集到NO B.收集到NO2 C.收集到O2 D.收集不到任何气体
1、下列说法正确的是
A.SiH4比CH4稳定
B.O2―半径比F―的小
C.Na和Cs属于第ⅠA族元素,Cs失电子能力比Na的强
D.P和As属于第ⅤA族元素,H3PO4酸性比H3AsO4的弱
23、以下是某同学测定硫酸铜晶体(CuSO4·xH2O)中结晶水含量的实验方案。
实验用品:硫酸铜晶体、研钵、干燥器、坩埚、三脚架、玻璃棒、药匙、托盘天平
实验步骤:
① 准确称量一个干净、干燥的坩埚;
② 在坩埚中加入一定量的硫酸铜晶体试样,称重,将称量的试样放入研钵中研细,再放回到坩埚中;
③ 将盛有试样的坩埚加热,待晶体变成白色粉末时,停止加热;
④ 将步骤③中的坩埚放入干燥器,冷却至室温后,称重;
⑤ 将步骤④中的坩埚再加热一定时间,放入干燥器中冷却至室温后称量。重复本操作,直至连续两次称量的质量差不超过0.1g为止;
⑥ 计算硫酸铜晶体化学式中x的实验值。
分析该方案并回答下面问题:
(1)完成本实验还需要的实验用品是 ;
(2) 指出实验步骤②中存在的错误并改正: ;
(3)硫酸铜不能放置在空气中冷却的原因是 ;
(4)步骤⑤的目的是 ;
(5)若坩埚的质量为m,坩埚与硫酸铜晶体的质量为m1,加热后称量坩埚与无水硫酸铜的质量为m2,则晶体CuSO4·xH2O中,x = (写表达式);
(6)下面的情况有可能造成测试结果偏高的是 (填序号)。
A.试样中含有加热不挥发的杂质 B.试样中含有加热易挥发的杂质
C.测试前试样已有部分脱水 D.实验前坩埚未完全干燥
E.晶体加热脱水不完全 F.加热时有晶体溅出
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com