
题目列表(包括答案和解析)
7. 氯原子序数为17,35 Cl是氯的一种同位素,下列说法正确的是
A. 35 Cl原子所含质子数为18
B. 1/18 mol的1 H35 Cl分子所含中子数约为6.02×1023
C. 3.5g的35 Cl2气体的体积为1.12 L
D. 35 Cl2气体的摩尔质量为70
6. 化学反应经常伴随着颜色变化,下列有关反应获得的颜色正确的是
①蛋白质遇浓硝酸→黄色;②淀粉溶液遇单质碘→蓝色:③溴化银见光分解→白色;④热的氧化铜遇乙醇→绿色;⑤新制氯水久置后→无色;⑥苯酚在空气中氧化→粉红色
A. ①②③⑤ B. ②④⑤ C. ①②⑤⑥ D. ②③⑥
28.(12分)某兴趣小组为了验证某种铁的氧化物(FexOy)中含有氧元素并测定其化学式,
设计了如下两套实验方案,按实验方案填写下列空白:
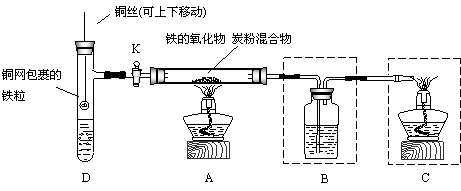
(1)验证铁的氧化物中含有氧元素:
①按上图连接好装置(B中已盛有适量的水),检验装置的气密性。简述检查A装置气密性的方法
②在A中硬质玻璃管内装入该铁的氧化物和炭粉的混合物,洗气瓶B内装
入 溶液,在依次点燃A、C两处的酒精灯前,通入氮气排净空气,则加热一段时间后,观察到B中溶液变浑浊,说明FexOy中含有氧元素。
③实验结束时,先熄灭C处酒精灯,再取出B中导管,最后熄灭A处酒精灯。如果操作顺序相反,可能会出现什么现象?
(2)为测定其化学式,将B、C改为如下图所示的装置,在A中硬质玻璃管内装入2.32g FexOy粉末(气密性良好)
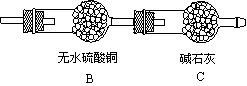
上述D中制H2的方法与将铁粒直接加入试管中相比,其优点是
②打开活塞K,通入H2,排尽装置内的空气,点燃A处酒精灯,进行反应。
C装置的作用
③待A中反应完全后,停止加热,仍要继续通入H2一段时间,目的是
④按该装置进行准确操作仍会出现较大误差,试分析可能原因
改进方案为
改进后进行实验,实验完毕卸下装置B,称量,发现其增重0.72g,则该铁的氧化物的化学式
27.(3分) 对以下课本中的实验: A:乙醛还原新制的氢氧化铜 B:乙酸乙酯的水解
C:实验室制乙烯 D:石油的分馏 E:中和热的测定 F:乙醛的银镜反应
按下列各操作的要求,用字母A B C.....填空
① 需用温度计的 , ② 需用水浴加热
③ 为防止液体暴沸,常需要加入碎瓷片的是
26.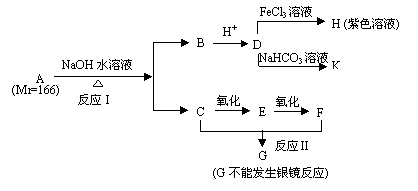 (11分)仅含C、H、O的化合物A为无色液体,难溶于水,有特殊气味。从A出发,可发生图示的一系列反应,化合物A的苯环上一元取代物只有两种
(11分)仅含C、H、O的化合物A为无色液体,难溶于水,有特殊气味。从A出发,可发生图示的一系列反应,化合物A的苯环上一元取代物只有两种
(1)写出下列物质的结构简式 A: D:
(2)反应类型:Ⅰ Ⅱ
(3)按要求写出反应的化学方程式
C → E
C + F → G
D与NaHCO3的反应
(4)写出与A是同分异构体,且满足下列条件的有机物的结构简式
① 苯环上仅有两个对位取代基 ;②遇FeCl3溶液显紫色;
③水解产物能发生银镜反应
25.(9分)右图所示,恒温条件下,某容器分隔成A、B两部分,A容积固定不变,B有可移动活塞,在相同温度下发生可逆反应 2SO3 (g) 2SO2 (g)+
O2(g)
2SO2 (g)+
O2(g)
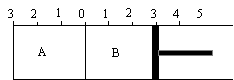
根据要求填写空白:
(1)如果A中充入2molSO2和1molO2,在B中充入2molSO2和1molO2,
则SO2转化率 大,先达到平衡的是 ,达平衡后,测得A中气体的总物质的量为2.1mol,则n(SO3)= mol
(2)如果A中充入2molSO2和1molO2,在B中充入2molSO3和1molN2
①固定活塞位置在3处不动,达到平衡时,A中压强 B中压强
(填大于;等于;小于)
②若要使A与B中的反应物与生成物物质的量之比相同,活塞的位置应在 处;
③若活塞右移到5处,达平衡后,A中SO3的物质的量 B中SO3的物质的量
(填大于;等于;小于)
④若B中活塞固定在4.5处,要使A和B中平衡状态与②相同,需再向B中
加入SO2 mol,加入O2 mol
23.(6分)已知下列几种烷烃的燃烧热如下:
烷烃 甲烷 乙烷 丙烷 丁烷 戊烷
燃烧热(kJ·mol-1) 890 1560 2220 2877 3536
今有89.6L(标况)某天然气,假设仅含甲烷和乙烷两种气体,燃烧时共放出热量4230kJ,
① 试写出乙烷气体燃烧的热化学方程式:
② 计算该天然气中甲烷的体积分数:
③ 从烷烃分子组成与燃烧热的关系考虑,由上述数据可总结出的近似规律是:
24.(12分)aA、bB、cC、dD、eE、均为短周期元素,a<e<c<b<d,e+c+d=31,A和B同主
族,C 和D也同主族,C、E相邻,A与其它元素均不同周期。
①A、E形成的四原子核化合物属 分子(极性、非极性), 其易液化,
原因是:
②A、C两元素组成的三种10电子的微粒的电子式 、 、
A、C形成的四原子核分子甲(甲是一种常见的“绿色氧化剂”)
的结构式为 ,写出该化合物电离方程式
③ 写出A、C、D形成的六原子核化合物乙的水溶液和甲的水溶液相互反应的化学方程式:
④从五种元素中任选三种元素,组成化合物x和y,在下列表格中按要求填写相应的化学式(每空只写一种即可)
|
x pH>7 |
y pH<7 |
|
抑制水的电离
|
抑制水的电离
|
|
促进水的电离
|
促进水的电离
|
22.(5分)常温下,把含0.01mol CH3COONa的溶液和含 0.04mol HCl的溶液混合
(1)混合后溶液中共有 种离子,
(2)溶液中有两种微粒的物质的量之和为0.01mol,它们是 和
(3)n(H+) – n(CH3COO-) – n(OH-) = mol
21.甲酸和乙酸都是弱酸,当它们的浓度均为0.10mol·L-1时,甲酸中的c(H+)约为乙酸中的c(H+)3倍,现有两种浓度不同的甲酸溶液a和b,以及0.10mol·L-1的乙酸,经测定它们的pH从大到小依次为:a 、乙酸、 b,由此可知
A.a的浓度小于乙酸的浓度 B.a的浓度大于乙酸的浓度
C.b的浓度小于乙酸的浓度 D.b的浓度大于乙酸的浓度
第Ⅱ卷(共7题 共58分)
20.碱性电池具有容量大、放电电流大的特点,因而得到广泛使用,锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为
Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s)下列说法错误的是
A.电池工作时,锌失去电子
B.电池正极反应式为: 2MnO2(s)+H2O(l)+2e-= Mn2O3(s)+2OH-(aq)
C.电池工作时,负极附近pH降低
D.正极是水电离出的H+在放电
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com