
题目列表(包括答案和解析)
1、化学与生活是紧密相联的,下列关于生活化学的说法正确的是
A.随着人们生活节奏的加快,方便的小包装食品已被广泛接受,为了防止中秋月饼等富脂食品氧化变质,延长食品的保质期,在包装袋中常放入生石灰
B.现在用的清洁燃料主要有两类:一类是压缩天然气,另一类为液化石油气,他们属于碳氢化合物
C.福尔马林是一种良好的杀毒剂,也可用来消毒自来水
D.保护加酶洗衣粉的洗涤效果,应用沸水溶解洗衣粉
7、以NA表示阿佛加德罗常数,下列说法中正确的是
A 53g碳酸钠中含NA个CO32- B 0.1molOH-含NA个电子
C 1.8g重水(D2O)中含NA个中子 D 标准状况下11.2L臭氧中含NA个氧原子
6、NA为阿佛加德罗常数,下述正确的是
A 80g硝酸铵含有氮原子数为2NA
B、1L 1mol/L的盐酸溶液中,所含氯化氢分子数为NA
C 标准状况下,11.2L四氯化碳所含分子数为0.5NA
D、在铜与硫的反应中,1mol铜失去的电子数为2NA
5、设NA表示阿伏加德罗常数,下列叙述中正确的是
A 常温常压下,11.2L氧气所含的原子数为NA
B 1.8g的NH4+离子中含有的电子数为NA
C 常温常压下,48gO3含有的氧原子数为3NA D 2.4g金属镁变为镁离子时失去的电子数为0.1NA
4、设NA为阿佛加德罗常数,下列说法不正确的是
A 标准状况下的22.4L辛烷完全燃烧,生成二氧化碳分子数为8NA
B 18g水中含有的电子数为10NA
C 46g 二氧化氮和46g四氧化二氮含有的原子数均为3NA
D 在1L2mol/L的硝酸镁溶液中含有的硝酸根离子数为4NA
3、下列说法正确的是(NA表示阿伏加德罗常数的值) A.28g氮气所含有的原子数目为NA
B.4g金属钙变成钙离子时失去的电子数目为O.1NA C.lmol甲烷的质量与NA个甲烷分子的质量之和相等
D. 标准状况下,22.4L甲烷和乙炔混合物所含的分子数为NA
2、依照阿佛加德罗定律,下列叙述正确的是
A、同温同压下两种气体的体积之比等于摩尔质量之比
B、同温同压下两种气体的物质的量之比等于密度之比
C、同温同压下两种气体的摩尔质量之比等于密度之比 D、同温同体积下两种气体的物质的量之比等于压强之比
1、设阿佛加德罗常数的符号为NA,标准状况下某种O2和N2的混合气体m克含有b个分子,则n克该混合气体在相同状况下所占的(L)体积应是
A 22.4nb/mNA B 22.4mb/bNA C 22.4nNA/mb D nbNA/22.4m
21(4分).用pH试纸测定溶液的pH,正确的是:________________________________。
22(16分).甲、乙、丙、丁分别是盐酸、碳酸钠、氯化钙、硝酸银4种溶液中的一种。将它们两两混合后,观察到的现象是:①甲与乙或丙混合都产生沉淀;②丙与乙或了混合也产生沉 淀;③丁与乙混合产生无色气体。回答下面问题:
(1)写出丁与乙反应的离子方程式:________________________________。
(2)这四种溶液分别是甲:________________、乙:________________、丙:________________、丁:________________。
23(8分).下列中学化学实验中,要使用温度计的是________________;要使用水浴加热的是________________。(均填序号,错答倒扣分)
①纤维素的水解 ②用蒸馏法制蒸馏水 ③硝酸钾的溶解度的测定 ④酚醛树指的制取 ⑤乙酸乙酯的水解 ⑥苯的硝化 ⑦石蜡的催化裂化 ⑧Fe(OH)3(胶体)的制备
24(4分).新制的CO2中常混有少量O2、H2S、HCl、H2O(g)四种杂质,可选用①浓H2SO4,②红热的铜丝网,③CuSO4溶液,④饱和的NaHCO3溶液,逐一除去杂质,得到干燥的CO2,正确的操作顺序为________________________________。
25(18分).实验室有一包KCl和AlCl3的固体混合物,通过以下实验可确定KCl和AlCl3的质量之比,试根据实验方法和主要步骤,回答有关问题:
(1)调整托盘天平的零点时,若指针偏向右边,应将右边的螺丝向_________旋动。
(2)某学生用已知质量为yg的表面皿准确称取Wg样品,他在托盘天平的右盘上放上(W +y)g的砝码,在左盘的表面皿中放入样品,此时指针稍偏右边,该学生应怎样操作_______________________________________;
(3)将样品置于烧杯中加适量水溶解,滴入过量的A溶液,烧坏中有沉淀物,则A溶液 的名称是________________________________;
(4)过滤,某学生欲用下图装置操作,错误之处应怎样纠正?
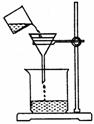
答:________________________________
(5)甲学生用水多次洗涤过滤所得沉淀物,然后使其干燥,得到固体纯净物C,质量为 W2g,C的名称是________________;
(6)乙学生将过滤所得滤液跟甲学生洗涤沉淀所得液体混合,然后蒸干溶剂,再充分加热,最后得到纯净KCl固体W1g,则原混合物中KCl与AlCl3身的质量之比的计算式为_________________。
26(30分).二氯化硫(SCl2)熔点-78℃,沸点59℃。密度1.638。遇水易分解。二氯化硫与三氧化硫作用可生成重要化工试剂亚硫酰氯(SOCl2)。以下是由氯气与硫反应合成二氯化硫的实验装置。
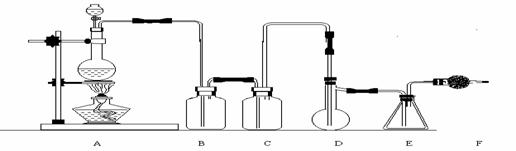
试回答下列问题:
(1)装置A中发生反应的化学方程式为: 。
(2)装置B盛放的药品是 C中是 。
(3)实验开始前先在D中放入一定量的硫粉,加热使硫熔化,然后转动和摇动烧瓶使硫附着在烧瓶内壁形成一薄层表面,这样做的目的是 。
(4)实验时,D装置需加热至50-59oC,最好采用何种方式 加热 。如何防止E中液体挥发 。
(5)F装置中干燥管内所盛物质是 作用是: 。
(6)二氯化硫电子式为: 由二氯化硫与SO3作用生成亚硫酰氯的化学方程式为: 。
广利高级中学高三化学班专题测验一 实验部分
20.某混合气体可能含N2、HCl、CO中的一种或几种,将其依次通过足量NaHCO3溶液和灼热的CuO,气体体积都没有变化;再通过足量Na2O2固体,气体体积减小;最后通过灼热的铜丝,充分反应后气体体积又减小,但还有气体剩余。以下判断中,正确的是
A.一定有N2和HCl,没有CO B.一定有N2,CO和HCl中至少有一种
C.一定有N2、CO和HCl D.一定没有N2,CO和HCl中至少有一种
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com