
题目列表(包括答案和解析)
18.密闭容器中,有反应:A2
+ B2  2AB,产物AB的生成情况如图
2AB,产物AB的生成情况如图
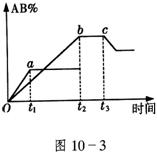 所示,a为500℃,b为300℃时的情况,c为300℃时从时间
所示,a为500℃,b为300℃时的情况,c为300℃时从时间 开 始向容器中加压的情况,下列叙述正确的是
开 始向容器中加压的情况,下列叙述正确的是
A.A2、B2、AB均为气体,正反应放热
B.AB为气体,A2、B2中最少有一种为非气体,正反应吸热
C.AB为气体,A2、B2中最少有一种为非气体,正反应放热
D.AB为固体,A2、B2中最少有一种为非气体,正反应吸热
17.下列离子方程式书写正确的是
A.向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全:
Ba2+ + OH- + H+ + SO42- == BaSO4↓+ H2O
B.将过量的NaOH溶液滴入同浓度的少量Ca(HCO3)2溶液
Ca2+ + 2HCO3-+2OH-====CaCO3↓+ 2H2O + CO32-
C.醋酸钡溶液和硫酸反应:Ba2++SO42-== BaSO4↓
D.向酸性FeSO4溶液中加H2O2溶液:
2Fe2+ + 2H2O2 + 4H+ ==2Fe3+ + 4H2O
16.氢氧化钠标准溶液因保存不当,吸收了少量的二氧化碳,若有1%的NaOH转变为Na2CO3,未知浓度的盐酸滴定25.00 mL此NaOH溶液来测定盐酸浓度,并选用甲基橙作指示剂,则盐酸浓度的测定结果会:
A.偏低1% B.偏高1% C.无影响 D.偏高0.1%
15.从海水中提取镁,可按如下步骤进行:
① 把贝壳制成石灰乳;②在引入的海水中加入石灰乳,沉降、过滤、洗涤沉淀物;
② 将沉淀物与盐酸反应,结晶过滤、在HCl气体氛围中干燥产物;④将得到的产物熔融电解得到镁。
下列说法不正确的是
A.此法的优点之一是原料来源丰富 B.第④步电解时阴极产生氯气
C.①②③步骤的目的是从海水中提取MgCl2
D.以上提取镁的过程中涉及化合、分解和复分解反应
14.A、B、C均为短周期元素,A、B同周期, A、C的最低价离子分别为A2-和C-,B2+和C-具有相同的电子层结构,下列说法中正确的是
A.原子序数:A>B>C B.原子半径:A>B>C
C.离子半径:A2->C->B2+ D.原子核外最外层电子数:A>C>B
13.容积相同的甲、乙密闭容器,甲为恒容、乙为恒压,分别充入2 molSO2和1 mol
O2,同时发生反应: 2SO2(g)+O2(g) 2SO3(g),同温度下分别达到平衡,测得甲中SO2的转化率为25%,下列说法中正确的是
2SO3(g),同温度下分别达到平衡,测得甲中SO2的转化率为25%,下列说法中正确的是
A.反应过程中甲容器中的反应速率比乙中的大
B.甲容器反应达到平衡时所需时间比乙容器少
C.乙容器中SO2的转化率大于25%
D.平衡时,乙容器中SO2、O2、SO3的浓度之比一定为2:1:2
12. 设NA表示阿伏加德罗常数,下列叙述中正确的是 :
A.常温常压下,11.2 L氧气所含的原子数为NA
B.1.8 g的 中含有的电子数为NA
中含有的电子数为NA
C.常温常压下,48 g O3含有的氧原子数为3NA
D.常温常压下1 mol NO2气体与水反应生成NA个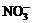 离子
离子
11.根据热化学方程式:S(s)+O2(g) = SO2(g);△H=-297.23 kJ/mol ,下列说法正确的是:
A.1molSO2 (g)的能量总和大于1molS(s)和1mol O2(g)的能量总和
B.1molSO2(g)的能量总和小于1molS(s)和1molO2(g)的能量总和
C.S(g)+O2(g) = SO2(g);△H= -Q kJ/mol ; Q的值大于297.23
D.S(g)+O2(g) = SO2(g);△H= -Q kJ/mol ; Q的值等于297.23
10.在下列实验中,可能达不到目的的是
A.用金属钠与水或乙醇反应,比较水和乙醇分子中羟基氢(-OH)的活泼性 B.用铂(Pt)电极电解Cu(NO3)2 、AgNO3 混合溶液,比较铜和银的金属活泼性 C.检测等物质的量浓度H3PO4和 H2SO4的酸性强弱,比较磷和硫两元素非金属性的强弱.
D.向无色溶液加BaCl2溶液,生成白色沉淀,再加稀硝酸,沉淀不消失,由此确定该溶液中一定含有SO42-
9.2004年美国圣路易斯大学研制了一种新型的乙醇电池,它用磺酸类质子溶剂,在200oC左右时供电,乙醇电池比甲醇电池效率高出32倍且更安全。

 电池总反应为:C2H5OH +3O2 2CO2 +3H2O,
电池总反应为:C2H5OH +3O2 2CO2 +3H2O,
电池示意如右图,下列说法不正确的是:
A.a极为电池的负极
B.电池工作时电流由b极沿导线经灯泡再到a极
C.电池正极的电极反应为:4H+ + O2 + 4e- = 2H2O
D.电池工作时,1mol乙醇被氧化时就有6mol电子转移
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com