
题目列表(包括答案和解析)
23、有X、Y、Z三种元素,已知①它们是周期表中前20号元素,X、Y和Z均不在同一周期;②它们可以组成化合物XY2、YZ2和XZ;③X的阳离子和Z的阴离子的核外电子排布相同;④Y很难形成简单的阳离子或阴离子。请填写下列空白:
(1)X___________;Y___________;Z___________。(填元素符号)。
(2)XY2与水反应的化学方程式是_______________________________。
(3)在XY2、YZ2和XZ中,含有非极性键的是___________________,含有极性键的非极性分子是____________________(填化学式)。
22.(8分)X、Y、Z为短周期元素的单质,U、V为它们的化合物,这些物质之间的关系如右图所示,其中反应条件和某些产物已经略去:
(1)如果X、Y的组成元素是同主族的,写出反应I的化学反应方程式:
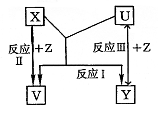 ①若已知V是水:
。
①若已知V是水:
。
②若已知U、V均为氧化物: 。
(2)如果X、Y的组成元素不同主族时,按下列要求回答问题。
①若X组成元素是地壳中含量最多的金属元素时,则X、Y、Z的化学式是:X为 ;Y为 ;Z为 。
②若Y组成元素在自然界中形成的化合物种类最多时,则V、U的化学式是:V为 ;U为 。
③若Z是通常情况下密度最小的物质,则反应I的化学反应方程式: 。
21、已知a、I、e为三种由短周期元素构成的粒子,它们都有10个电子,其结构特点如下:
|
粒子代码 |
a |
I |
e |
|
原子核数 |
单核 |
四核 |
双核 |
|
粒子的电荷数 |
一个单位正电荷 |
0 |
一个单位负电荷 |
物质A由a、e构成,B、C、D、K都是单质,反应①-⑤都是用于工业生产的反应,各有关物质之间的相互反应转化关系如下图所示:请填写下列空白:
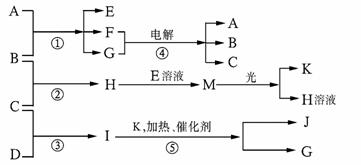
(1)写出下列物质的化学式:
A、 D、 F、____________________
J、 K、
(2)写出下列反应的离子方程式:
①H+E(溶液)→M 。
②I溶于G 。
(3)在通常状况下,若1 g C气体在B气体中燃烧生成H气体时放出92.3 kJ热量,则2 mol H气体完全分解生成C气体和B气体的热化学方程式为 。
20、甲、乙、丙、丁为四种短周期元素,在周期表中,甲与乙、丙、丁在周期表中位置关系如右图所示(乙、丙、丁未标出)。已知四种元素的原子序数之和为40,丁的原子序数与乙、丙原子序数之和相等,四种元素原子的最外层电子数之和为24。
(1)甲元素在周期表中的位置是第 周期第 族。
(2)这四种元素可按原子个数比1∶2两两化合,
形成的化合物的化学式有 、 、 。(写出三种即可)
(3)乙、丙两元素可形成AB3型化合物,其电子式可表示为 。
19、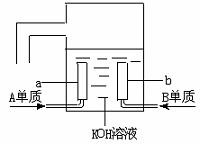 A、B、C、D是四种短周期元素,它们的原子序数依次增大,其中A与C,B与D分别是同主族元素;已知B、D二元素原子核中质子数之和是A、C二元素原子核中质子数之和的2倍;四种元素形成的单质中有两种是气体;两种是固体。回答:
A、B、C、D是四种短周期元素,它们的原子序数依次增大,其中A与C,B与D分别是同主族元素;已知B、D二元素原子核中质子数之和是A、C二元素原子核中质子数之和的2倍;四种元素形成的单质中有两种是气体;两种是固体。回答:
(1)写出由B、C二元素所形成的原子个数比为1∶1的化合物的电子式__________,其晶体中存在的化学键有____________________(填化学键名称)。
(2)写出两种均由A、B、C、D四种元素组成的化合物的化学式__________、__________。
这两种化合物的水溶液发生反应的离子方程式为_________ ______。
(3)用A元素的单质与B元素的单质可制成新型的化学电源,已在宇宙飞船中使用。其构造如下图所示。两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电。则a是____极,电极反应式为____________________,b是_____极,电极反应式为__________ __________。
|
|
甲 |
|
|
|
|
18.水分子间存在一种叫“氢键”的作用(介于范德瓦尔斯力与化学键之间)彼此结合而形成(H2O)n。在冰中每个水分子被4个水分子包围形成变形的正四面体,通过“氢键相互连接成庞大的分子晶体一次,其结构示意图如图所示
⑴1mol冰中有 mol“氢键”
⑵水分子可电离生成两种含有相同电子数的微粒,其电离方程式为: 。
⑶在冰的结构中,每个水分子与相邻的4个水分子以氢键相连接。在冰晶体中除氢键外,还存在范德瓦尔斯力(11kJ•mol-1)。已知冰的升华热是51 kJ•mol-1,则冰晶体中氢键的能量是 kJ•mol-1
⑷用x、y、z分别表示H2O、H2S、H2Se的沸点(℃),则x、y、z的大小关系是 ,其判断依据是______________________________________________________________
________________________________________________________________________。
17.有A、B、C、D四种元素,A元素的气态氢化物分子式为RH4,其中R的质量分数为75%,该元素核内有6个中子,能与B形成AB2型化合物,B在它的氢化物中含量为88.9%,核内质子数和中子数相等,C、D为同周期元素,D的最高价氧化物的水化物为酸性最强的酸,C的氧化物为两性氧化物。
(1)A元素的一种无色透明的单质,名称叫______,其晶体类型是______。
(2)B的氢化物的电子式为______,属______分子。(极性或非极性)
(3)A和B形成化合物的分子空间构型为______,属______分子,其晶体类型是______。俗名______。
 (4)C元素位于周期表中第______周期______族,A、C、D三元素的最高价氧化物的水化物按酸性由强到弱的顺序排列(用分子式表示)______。
(4)C元素位于周期表中第______周期______族,A、C、D三元素的最高价氧化物的水化物按酸性由强到弱的顺序排列(用分子式表示)______。
(5)C和D的化合物溶于水后滴入过量KOH,现象是______,离子方程式______。
16. 石墨能与熔融金属钾作用,形成石墨间隙化合物,钾原子填充在石墨各层碳谈原子中。比较常见的石墨间隙化合物是青铜色的化合物,其化学式可写作CxK,其平面图形见下图,则x值为( )
石墨能与熔融金属钾作用,形成石墨间隙化合物,钾原子填充在石墨各层碳谈原子中。比较常见的石墨间隙化合物是青铜色的化合物,其化学式可写作CxK,其平面图形见下图,则x值为( )
A . 8 B. 12 C.24 D.60
15. 高温下,超氧化钾晶体呈立方体结构。晶体中氧的化合价部分为0价,部分为-2价。如图为超氧化钾晶体的一个晶胞(晶体中最小的重复单元)。则下列说法正确的是
( )
高温下,超氧化钾晶体呈立方体结构。晶体中氧的化合价部分为0价,部分为-2价。如图为超氧化钾晶体的一个晶胞(晶体中最小的重复单元)。则下列说法正确的是
( )
A.超氧化钾的化学式为KO2,每晶胞含有4个K+和4个O2-
B.晶体中每个K+周围有8个O2-,每个O2-周围有8个K+
C.晶体中与每个K+距离最近的K+有8个
D.晶体中,0价氧原子与-2价氧原子的数目比为3:1
14.食盐晶体如图1所示。在晶体中,· 表示Na+,o 表示Cl-。已知食盐的密度为r g / cm3,NaCl摩尔质量M g / mol,阿伏加德罗常数为N,则在食盐晶体里Na+和Cl-的间距大约是( )
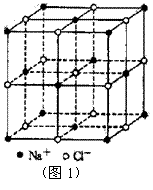 A.
A. 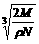 cm
B.
cm
B. 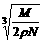 cm
cm
C. 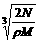 cm
D.
cm
D. 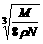 cm
cm
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com