
题目列表(包括答案和解析)
18、14、将7.8 gMg Al合金溶于120ml 4mol/L H2SO4中,当合金完全溶解后,再加入120 ml 8mol/L的NaOH溶液,得到沉淀的质量为21.4g,则加入H2SO4时产生的氢气的物质的量为 A、0.4 mol B、0.6mol C、0.8mol D、1.0mol
17、在FeCl3和AlCl3的混合液中,先加入过量的NaI溶液,再加入足量的Na2S溶液,则所得的沉淀是 A、Al2S3 和 I2 B、Fe(OH)2 和 Al(OH)3 C、Fe2S3 和I2 D、 FeS 、 S、 Al(OH)3
16、高铁电池是一种新型可充电电池,与普通高能电池相比,该电池长时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O  3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是
A、放电时负极反应为:Zn-2e-+2OH-=Zn(OH)2
B、充电时阳极反应为:Fe(OH)3-3e-+5OH-=FeO42-+4H2O
C、放电时每转移3mol电子,正极有1mol K2FeO4被氧化
D、放电时正极附近溶液的碱性增强
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是
A、放电时负极反应为:Zn-2e-+2OH-=Zn(OH)2
B、充电时阳极反应为:Fe(OH)3-3e-+5OH-=FeO42-+4H2O
C、放电时每转移3mol电子,正极有1mol K2FeO4被氧化
D、放电时正极附近溶液的碱性增强
15、下列各组物质的稀溶液相互反应,无论是前者滴入后者,还是后者滴入前者,反应现象都相同的是( )
A NaHSO4和Ba(OH)2 B Na2CO3和HCl
C NaAlO2和H2SO4 D Al2 (SO4)3和NaHCO3
14、对于平衡体系:mA(g)+nB(g) 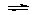 pC(g)+qD(g)(正反应放热),有下列判断,其中正确的是
A.若温度不变,将容器的体积增大1倍,此时A的浓度变为原来的0.58倍,则m+n<p+q
B.若反应从正反应开始,达平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m : n
C.若平衡体系中共有气体amol,再向其中加入bmolB,当重新达到平衡时,气体的总物质的量等于(a+b),则m+n=p+q
D.若m+n=p+q,则当容器内温度升高时,平衡逆向移动,但容器中气体的压强不变。
pC(g)+qD(g)(正反应放热),有下列判断,其中正确的是
A.若温度不变,将容器的体积增大1倍,此时A的浓度变为原来的0.58倍,则m+n<p+q
B.若反应从正反应开始,达平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m : n
C.若平衡体系中共有气体amol,再向其中加入bmolB,当重新达到平衡时,气体的总物质的量等于(a+b),则m+n=p+q
D.若m+n=p+q,则当容器内温度升高时,平衡逆向移动,但容器中气体的压强不变。
13、下列叙述正确的是 A、反应Na2O2+2HCl=2NaCl+H2O2为氧化还原反应 B、反应:
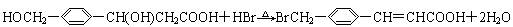 仅涉及消去反应类型
C、10mL
0.02 mol/L AgNO3溶液与10mL
0.02 mol/L HCl溶液混合后,溶液的pH=2(设溶液总体积不变)
D、10mL
0.04 mol/L HCl溶液与10mL 0.02 mol/L Na2CO3溶液混合后,溶液的pH=7(设溶液总体积不变)
仅涉及消去反应类型
C、10mL
0.02 mol/L AgNO3溶液与10mL
0.02 mol/L HCl溶液混合后,溶液的pH=2(设溶液总体积不变)
D、10mL
0.04 mol/L HCl溶液与10mL 0.02 mol/L Na2CO3溶液混合后,溶液的pH=7(设溶液总体积不变)
12、物质发生化学变化时:①电子总数 ②原子总数 ③分子总数 ④物质的种类 ⑤物质的总质量 ⑥物质的总能量,反应前后肯定不发生变化的是 A.①②③⑤ B.①②⑤ C.②⑤⑥ D.①④⑤⑥
11、下列实验操作或事故处理中,正确的做法是 A 银镜反应实验后附有银的试管,可用稀H2SO4清洗 B 在中学《硫酸铜晶体里结晶水含量测定》的实验中,称量操作至少需要四次 C 为检验酸性溶液中的Cl-和SO42-,先加硝酸银溶液,滤去沉淀后硝酸钡溶液 D 在250mL 烧杯中,加入216mL水和24gNaOH固体,配制10%NaOH溶液
10、可用于鉴别以下三种化合物的一组试剂是
 ①银氨溶液 ②溴的四氯化碳溶液 ③氯化铁溶液 ④氢氧化钠溶液
A ②与③ B ③与④ C ①与④ D ①与②
①银氨溶液 ②溴的四氯化碳溶液 ③氯化铁溶液 ④氢氧化钠溶液
A ②与③ B ③与④ C ①与④ D ①与②
9、某学生用NaHCO3和KHCO3组成的某混合物进行实验,测得如下数据(盐酸的物质的量浓度相等),下列分析推理不正确的是 ( )
|
|
50ml盐酸 |
50ml盐酸 |
50ml盐酸 |
|
m(混合物) |
9.2g |
15.7g |
27.6g |
 (标况) (标况) |
2.24L |
3.36L |
3.36L |
A.盐酸的物质的量浓度为3.0mol·L-1
B.根据表中数据不能计算出混合物中NaHCO3的质量分数
C.加入混合物9.2g时盐酸过量
D.15.7g混合物恰好与盐酸完全反应
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com