
题目列表(包括答案和解析)
20.(1)原理:若生成物的混合物显强酸性,则生成的沉淀为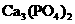
 .若生成物的混合物不显酸性,则生成的沉淀为
.若生成物的混合物不显酸性,则生成的沉淀为
 (2)A:将氯化钙溶液滴入到
(2)A:将氯化钙溶液滴入到 溶液中过量至不再沉淀为止. B:沉淀静置 C:取一小段pH试纸放在干燥洁净的表面皿.用洁净干燥的玻璃棒蘸取溶液滴到pH试纸 D:与标准比色卡对照,若溶液呈酸性,则证明生成的为
溶液中过量至不再沉淀为止. B:沉淀静置 C:取一小段pH试纸放在干燥洁净的表面皿.用洁净干燥的玻璃棒蘸取溶液滴到pH试纸 D:与标准比色卡对照,若溶液呈酸性,则证明生成的为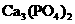 ;反之则证明为
;反之则证明为 .
.
20(1)0.12 (2分) (2)B (1分)(3)检查装置的气密性 (1分)(4)反应起止的时间 (1分) 排入量筒中水的体积 (1分) 快 (1分)同浓度的盐酸比醋酸溶液中的H+ 浓度大 (1分) (5)AC (2分) B (1分)
26、(10分)Fe2O3、ZnO、CuO的混合固体粉末a g,在加热条件下用足量的CO还原,得到金属混合物2.41g,将生成的CO2气体用足量的澄清石灰水吸收后,产生5.00g白色沉淀。 (1)a= g。 (2)若a g Fe2O3、ZnO、CuO的混合物总物质的量为bmol,则Fe2O3的物质的量为 mol。(用b的代数式表示) (3)将a g Fe2O3、ZnO、CuO的混合物溶于足量的盐酸中,再加入适量的铁粉,溶液中的Fe3+、Cu2+全部被还原,同时收集到224mL H2(标准状况下),共用去0.03mol铁粉。求原混合物中Fe2O3、ZnO、CuO的物质的量分别是多少?
19 BCDGJK
25、(6分)在20℃时食盐水的溶解度为36g,取一定量该温度下的饱和溶液用惰性电极进行电解,当阳极析出11.2L气体时(标准状况),食盐水完全电解,所得溶液密度为1.20g/mol。试计算:
(1)电解时,所取饱和食盐水的质量为 g。
(2)电解后溶液中NaOH的物质的量浓度为 mol/L。
(3)要使溶液恢复原状态,需加入 g, 物质
24、(9分)一种用于治疗高血脂的新药灭脂灵(Hepronicate)是按如下路线合成的:
 已知:
已知:
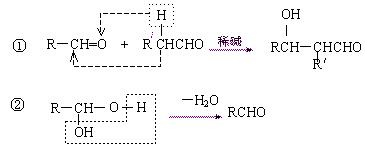 其中G的分子式为C10H22O3
,试回答:
(1)写出结构简式: B
E
;
(2)上述反应中属于取代反应的是
(填序号);
(3)写出反应方程式:
Ⅰ、反应②
;
Ⅱ、反应⑤
;
Ⅲ、F与银氨溶液反应:
。
其中G的分子式为C10H22O3
,试回答:
(1)写出结构简式: B
E
;
(2)上述反应中属于取代反应的是
(填序号);
(3)写出反应方程式:
Ⅰ、反应②
;
Ⅱ、反应⑤
;
Ⅲ、F与银氨溶液反应:
。
23.(8分)在一个固定体积的密闭容器中,向容器中充入2 mol A和1 mol
B,发生如下反应:2A(g) + B(g)  3C(g) + D(s),反应达到平衡时C的浓度为1.2 mol/L。
3C(g) + D(s),反应达到平衡时C的浓度为1.2 mol/L。
⑴若使容器温度升高,平衡时混合气体的平均相对摩尔质量减小,则正反应为________(填“吸热”或“放热”)反应。
⑵若维持容器体积和温度不变,按下列方法加入起始物质,达到平衡时C的浓度仍为1.2 mol/L的是_________(用序号填空)
①4 mol A+2 mol B ②3mol C+1 mol D+l mol B
③3 mol C+2 mol D ④1.6 mol A+0.8 mol B+0.6 mol C
⑶某温度下,向容器中加入3 mol C和0.8 mo1 D,反应达到平衡时C的浓度仍为1.2 mol/L,则容器的容积V应大于_________L,小于________L。
22、(9分)A、B、C、D、E、F是常见单质,其中A是用量最大,应用最广泛的金属;元素D是地壳中含量最多的金属元素;D元素和E元素在周期表中相邻。G、H、I、J、K、L是常见化合物,其中G在常温下是无色液体,H是黑色固体。以上物质相互间的转化关系如下图所示:
 请回答下列问题:
(1)元素A在元素周期表中的位置为
周期
族。 (2)写出K的电子式 。
(3)写出H和D反应的化学方程式 。
(4)D能与氢氧化钠溶液反应,请写出该反应的离子方程式
。
(5)写出A与G反应的化学方程式 。
(6)K与E反应时产生的现象有
;
该反应的化学方程式为 。
请回答下列问题:
(1)元素A在元素周期表中的位置为
周期
族。 (2)写出K的电子式 。
(3)写出H和D反应的化学方程式 。
(4)D能与氢氧化钠溶液反应,请写出该反应的离子方程式
。
(5)写出A与G反应的化学方程式 。
(6)K与E反应时产生的现象有
;
该反应的化学方程式为 。
21、(11分)右图是中学化学中常见物质之间的相互转化关系。其中,X是气体单质,Y是液体化合物,Z是常见的碱且焰色反应为黄色;W、L是固体单质,K、I中含有相同的元素;反应①是高温下进行的工业上制取H的第一步反应。

请按要求填空:
(1)G、H的化学式分别为
G 、 H ,
Y、Z的电子式分别为
Y 、Z ;
(2)写出下列反应的化学方程式:
① ;
④ ;
⑨ ;
(3)反应⑩中生成 1molL时,转移的电子数为 。(16分)右图是中学化学中常见物质之间的相互转化关系。其中,X是气体单质,Y是液体化合物,Z是常见的碱且焰色反应为黄色;W、L是固体单质,K、I中含有相同的元素;反应①是高温下进行的工业上制取H的第一步反应。
20、(9分)某研究性学习小组为了证明在同温同压下,相同浓度相同体积的酸性强弱不同的一元酸与足量镁带反应的速率不同,但是产生的氢气的体积相同。
 在下图装置中的锥形瓶中分别装入1mol·L-1的盐酸和醋酸各10mL,进行实验。
在下图装置中的锥形瓶中分别装入1mol·L-1的盐酸和醋酸各10mL,进行实验。
(1)分别称取除去表面氧化膜的镁带a g,并系于塑料棒末端。则a的数值至少为_____g
(2)本实验中应选用_______(填序号)的量筒。
A.100mL B.200mL C.500mL
(3)在广口瓶中装足量的水,按图连好装置后,要_____
(4)将塑料棒向下移动,使镁带全部浸入酸中,至酸反应完全。为了比较反应速率,应
记录的实验数据是____________________;为了比较产生氢气的体积,应记录的数
据是 _____________。实验结果表明:镁带和盐酸的反应速率比镁带和醋酸的
反应速率______(填“快”或“慢”),理由是 。
(5)下列情况中可能导致反应速率变快的是_______(填序号,多填扣分,下同);可能
导致产生氢气的体积减小的是
A.镁带中含有少量跟酸不反应的杂质
B.没有除去镁带表面的氧化镁
C.镁带中含有少量杂质铁
19、(14分)
(1)(3分)下列有关实验的叙述,正确的是(填序号) (A)配制500mL某物质的量浓度的溶液,可用两只250mL的容量瓶 (B)用渗析法分离淀粉中混有的NaCl杂质 (C)无法用分液漏斗将甘油和水的混合液体分离 (D)用酸式滴定管量取20.00mL高锰酸钾溶液 (E)为了测定某溶液的pH,将水经湿润的pH试纸浸入到待测溶液,过一会取出,与标准比色卡进行对比 (F)用浓氨水洗涤做过银镜反应的试管 (G)配制银氨溶液时,将稀氨水慢慢滴加到硝酸银溶液中,产生沉淀后继续滴加到沉淀刚好溶解为止 (H)浓硫酸不小心沾到皮肤上,立刻用稀NaOH溶液洗涤 (J)在氢氧化铁胶体中加主少量硫酸会产生沉淀 (K)用结晶法可以除去硝酸钾中混有少量氯化钠
(2)(11分) 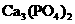 、
、 均为难溶于水的白色固体.某同学向
均为难溶于水的白色固体.某同学向 溶液中滴加
溶液中滴加 溶液至恰好反应,生成白色沉淀.试设计一个简单的实验方案,来证明所生成的白色沉淀是
溶液至恰好反应,生成白色沉淀.试设计一个简单的实验方案,来证明所生成的白色沉淀是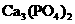 还是
还是 .(已知:
.(已知: 水解程度大于电离程度)
水解程度大于电离程度)
|
实验原理______________________________________________________ 实验用品及试剂:烧杯、玻璃棒、试管、滴管;石蕊试液、酚酞、pH试纸 |
|
实验步骤、现象及结论:(可以不填满) 1.___________________________________________________________ 2.___________________________________________________________ 3.___________________________________________________________ 4.___________________________________________________________ 5.___________________________________________________________ |
第Ⅱ卷 (非选择题共76分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com