
题目列表(包括答案和解析)
1、X和Y属短周期元素,X原子的最外层电子数是次外层电子数的一半,Y位于X的前一周期,且最外层只有一个电子,则X和Y形成的化合物的化学式可表示为 A、XY B、XY2 C、XY3 D、X2Y3
25.(10分)将3.20g Cu溶于amol·L-1过量的硝酸溶液30.0mL中,假设硝酸的还原产物只有NO2和NO,反应结束后,将所剩余溶液加水稀释至1000mL,测得c(NO3―)为0.200mol·L-1。求:
(1)稀释后溶液的pH。
(2)生成的气体中NO2和NO的物质的量(用含“a”的关系式表示)。
(3)用NaOH溶液吸收氮的氧化物是防止NOx污染的一种方法。原理为:
2NO2+2NaOH=NaNO3+NaNO2+H2O NO2+NO+2NaOH=2NaNO2+H2O
若生成的混合气体能被NaOH溶液完全吸收,试讨论a的取值范围。
24.(4分)现有1mol·L-1 H2SO4和0.5mol·L-1 Na2SO4混合液200mL,要使H2SO4和Na2SO4的物质的量浓度分别变为2mol·L-1和0.2mol·L-1,应加入55.8%的H2SO4溶液(密度为1.35g·cm-3)多少毫升后,再加水配制?
23.(10分)A、B都是芳香族化合物。1 mol A和1 mol某一元羧酸发生酯化反应生成B。B能在一定条件下发生银镜反应而A不能;A、B的相对分子质量都不超过200,完全燃烧都只生成CO2和H2O;A中氧元素的质量分数为31.6%,B的溶液有酸性但不能和FeCl3溶液发生显色反应。
(1)A、B相对分子质量的差值为______________________________________________。
(2)一个A的分子中应有________个(选填2、3、4)氧原子,作出此判断的理由是:_______ ___________________________________________________________________________________________________________。A的分子式是:____________。
(3)B的同分异构体甚多。其中不属于酚类且l mol能与4 mol NaOH反应的同分异构体的结构简式为:______________________________________(任写一种)。
22.(10分)A为甲、乙两种短周期元素组成的化合物,其摩尔质量为100g·mol – 1,甲元素的原子最外层电子数与K层电子数相等,E的水溶液显碱性,K为乙元素的单质。C为单质,其原子在周期表中半径最小。D为气体,对空气的相对密度为1.103。在适当的条件下,它们相互之间有如下图所示的转化关系:
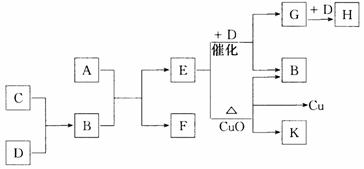
试填写下列空白:
(1)甲元素的单质在空气中燃烧出得到A外,还可得到__________________,物质F的电子式为 。
(2)反应“E + D→G + B”在 工业中的重要反应之一,“E + CuO”的化学方程式为:______________________________。
(3)C和D还能在一定条件下反应生成另一种化合物I,I与一种弱酸的酸性氧化物反应生成强酸,该反应的离子方程式为 。
21. (12分)元素周期表是学习化学的重要工具,它包含了许多的信息和规律。下表是元素周期表的一部分,请从下表①-⑩十种元素中选择适当的元素回答下列问题:
|
族 周期 |
I A |
II A |
III A |
IV A |
V A |
VI A |
VII A |
|
1 |
① |
|
|||||
|
2 |
② |
③ |
④ |
|
⑤ |
⑥ |
|
|
3 |
|
⑦ |
⑧ |
|
|
⑨ |
⑩ |
(1)表中元素形成的四核10电子阳离子的化学式为 ,形成的四核18电子分子的化学式为_____。
(2)已知某些不同族元素的性质也有一定的相似性,如元素③与元素⑧的氢氧化物有相似的性质,写出元素③的氢氧化物与NaOH溶液反应的离子方程式___ _ ___。与元素⑦的性质相似的不同族元素是________(填元素符号)。
(3)某元素原子的次外层为2个电子,其最高正价与最低负价的代数和为2,则该元素的名称是____。另有一元素,其原子的核外电子数等于电子层数。这两种元素可以形成多种化合物,其中有一种离子化合物A中两元素的原子个数比为1:5,它的所有原子的最外层都符合相应稀有气体原子的最外层电子结构。写出A的电子式 。A物质与水反应生成一种碱和无色气体,写出有关的化学方程式 ,该反应中的还原剂为 。
(4)物质熔沸点的高低与该物质的晶体结构有关。④的单质晶体熔点为2573K,沸点2823K,硬度大,则属于 晶体。某同学猜想⑧和⑩形成的化合物B晶体类型与NaCl相同,则B的熔沸点应 (填“高于”或“低于”)NaCl。如果用实验证明上述猜想不正确,你的实验方案是
。
20.(10分)在一个固定容积的密闭容器中,保持一定温度,在一定条件下进行以下反应:A(g)+B(g)  2C(g)。已知加入1 mol
A和2 mol B且达到平衡后,生成了a mol C,此时C在平衡混合气体中的物质的量分数为a。在相同实验条件下,回答下列问题:
2C(g)。已知加入1 mol
A和2 mol B且达到平衡后,生成了a mol C,此时C在平衡混合气体中的物质的量分数为a。在相同实验条件下,回答下列问题:
(1) 若往同一容器中加入2 mol A、4 mol B,达到平衡后,C的物质的量为 ______ mol,此时C在平衡混合气中的物质的量分数将________a(填大于、小于或等于)。
(2) 若往同一容器中加入了0.5 mol C,若要求平衡后C的物质的量为0.5a mol,平衡后C的物质的量分数仍为a,则还应往容器中加入什么物质,其物质的量是多少(注意:不再加入C)?_____ _______
(3) 若往同一容器中加入2 mol A、6 mol B,若要求平衡后C的物质的量分数仍为a,则应加入C __________ mol,平衡后C的物质的量为 ___________ mol。
19.(12分)某化学反应2A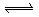 B+D在四种不同条件下进行B、D起始浓度为零,反应物A的浓度(mol/L),随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行B、D起始浓度为零,反应物A的浓度(mol/L),随反应时间(min)的变化情况如下表:
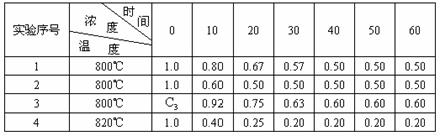
根据上述数据,完成下列填空:
(1)实验1,反应在10至20分钟时间内平均速率为____ __ ,
实验2中还隐含的条件可能是________________ ____;
(2)设反应速率实验3为 ,实验1为
,实验1为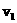 ,若相同时间内
,若相同时间内 >
>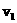 ,则c3___1.0mol/L(填>、=、<
,则c3___1.0mol/L(填>、=、< ,理由是____________________
_____;
,理由是____________________
_____;
(3)该反应是________反应(选填吸热、放热),理由是_________________________.
18.(12分)某校化学兴趣小组的同学对硝酸盐的受热分解进行探究。他们设计了如下装置分别加热了NaNO3、Cu(NO3)2、AgNO3。(加热及夹持装置未画出)
(1) 甲同学加热的是NaNO3。加热时发现:装置②中有能使带火星的木条复燃的气体产生;并已知参加反应的NaNO3和生成气体的物质的量之比为2:1。请写出NaNO3受热分解后另一产物的化学式 ;
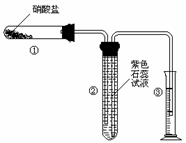 (2) 乙同学加热的是Cu(NO3)2。加热过程发现:装
(2) 乙同学加热的是Cu(NO3)2。加热过程发现:装
置②中也有气泡产生,但在上升的过程中完全消失。
装置①中的固体逐渐变为黑色。请写出Cu(NO3)2
受热分解的化学方程式: ;实
验过程中还应看到的现象为 。
(3)丙同学加热的是AgNO3。加热过程发现:装置②中也有气泡产生,但在上升的过程中气泡部分消失,剩余的气体也能使带火星的木条复燃,装置①中的固体逐渐变为黑色。丙同学据此写出了AgNO3受热分解可能的两种化学方程式:
(Ⅰ)4AgNO3 2Ag2O+4NO2↑+O2↑ (Ⅱ) 2AgNO3
2Ag2O+4NO2↑+O2↑ (Ⅱ) 2AgNO3 2Ag+2NO2↑+O2↑
2Ag+2NO2↑+O2↑
请你分析,可能正确的是哪一个并说明理由: ;
请你设计一个简单的实验证明你的结论是正确的: ;
(4)由上述3个实验的结果,请你归纳出有关硝酸盐分解的一个结论。你的结论是 。
17.(6分)下列是某学习小组的同学关于某无色溶液中所含离子鉴别的实验设计方案。请指出存在问题的实验方案,并说明理由(有几组写几组,不一定填满,多写倒扣分)。
A.加入KSCN溶液后,溶液不显红色,再加几滴氯水,溶液颜色变为红色。说明原溶液中含Fe2+
B.加入BaCl2溶液,生成白色沉淀,加稀硝酸沉淀不消失,可确定有SO42-存在
C.通入Cl2后,溶液变为黄色,加入淀粉溶液后溶液变蓝,可确定有I-存在
D.加入盐酸后,生成的气体能使澄清石灰水变浑浊,则原溶液中一定有CO32-
E.加入浓NaOH溶液并加热,产生使湿润红色石蕊试纸变蓝的气体,说明溶液中含NH4+
(1) (2) (3)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com