
题目列表(包括答案和解析)
18.(8分)A、B、C、D四种短周期元素,原子序数依次增大;A和C能形成一种分子X或一种+1价阳离子Y;B元素的原子最外层电子数是次外层电子数的2倍;C、D在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体。
试回答下列问题:
(1)A、B的元素符号分别为______________________、_______________________。
(2)写出Y水解的离子方程式_____________________________________________。
(3)将9 g B单质在空气中充分燃烧,所得气体通入l L l mol/LNaOH溶液中,气体被完全吸收后,溶液中各离子浓度由大到小的顺序是 。
(4)在101 kPa时,1 g X气体在D单质中充分燃烧,生成一种液态化合物和另一种对环境无污染的稳定物质,放出18.6 kJ的热量。该反应的热化学方程式为 ___________________________________________________________________。
17.(8分)X、Y、A、B、C、D是中学化学常见的物质,且有如下图所示转化关系。气体C的相对分子质量比气体X的相对分子质量大2,产物中水已忽略:

 气体氧化物X
气体氧化物X
浓硝酸




 气体氧化物X
固体单质A
气体氧化物X
固体单质A

 点燃
加热 红棕色气体C
点燃
加热 红棕色气体C




 固体单质Y
固体氧化物B
固体单质Y
固体氧化物B
回答下列问题:
(1) X分子中含________键(填“极性”或“非极性”),X为________分子(同前);
(2) 在上述转化过程中,作还原剂的物质有(填物质的化学式)______________;
(3) A与硝酸反应的化学方程式为____________________________________;
(4) 测定气体C的相对分子质量时,测得的数值与气体C的相对分子质量有差异的原因是(用化学方程式表示)_______________________________;
16. 有一瓶无色溶液,可能含有K+、Al3+、Mg2+、NH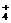 、Cl
–、SO
、Cl
–、SO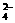 、HCO
、HCO 、MnO
、MnO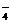 离子中的几种。为确定其成分,做如下实验:①取部分溶液,加入适量Na2O2固体,产生无色无味的气体和白色沉淀,再加入足量的NaOH溶液后白色沉淀部分溶解;②另取部分溶液,加入HNO3酸化的Ba(NO3)2溶液,有白色沉淀产生。下列推断正确的 ( )
离子中的几种。为确定其成分,做如下实验:①取部分溶液,加入适量Na2O2固体,产生无色无味的气体和白色沉淀,再加入足量的NaOH溶液后白色沉淀部分溶解;②另取部分溶液,加入HNO3酸化的Ba(NO3)2溶液,有白色沉淀产生。下列推断正确的 ( )
A.肯定有Al3+、Mg2+、NH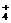 、Cl
– B.肯定有Al3+、Mg2+、HCO
、Cl
– B.肯定有Al3+、Mg2+、HCO
C.肯定有K+、HCO 、MnO
、MnO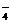 D.肯定有Al3+、Mg2+、SO
D.肯定有Al3+、Mg2+、SO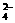
15. 使用酸碱中和滴定的方法,用0.01mol/L盐酸滴定锥形瓶中未知浓度的NaOH溶液,下列操作能够使测定结果偏高的是:
|
A.仅①③ B.仅②④ C.仅②③④ D.①②③④
14.已知Mg(OH)2在水中溶解可以建立平衡状态:
Mg(OH)2(s)  Mg2+(aq)+2OH-(aq)。
Mg2+(aq)+2OH-(aq)。
在25℃时,将质量为W g的 Mg(OH)2加入水中形成100mL amol/L的溶液,水中还有b g末溶的Mg(OH)2固体。向其中再加入100m L水,并充分搅拌,未溶固体由bg变为c g(c>0),此时溶液中Mg(OH)2的物质的量浓度为(单位:mol/L)
A.a B.(W-b)/58 C.(W-c)/58 D.(W-b-c)/11.6
13.新型的乙醇电池结构如图所示,它用碘酸类质子溶剂,在200℃左右时供电,其效率比甲醇电池高出32倍,且更安全。已知电池总反应式为C2H5OH+3O2 2CO2+3H2O。
下列说法不正确的是:
A.a极为电池的负极,该电极发生氧化反应
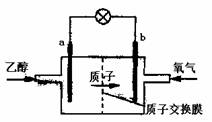
B.电池工作时电子由a极流出沿导线经灯泡到b极
C.电池正极的电极反应式为O2+2H2O +4e-
4OH-
D.电池工作时,1mol乙醇被氧化转移12mol电子
12.常温时,将V1mL c1mol·L-1的氨水滴加到V2mL c2moL·L-1的盐酸中,下列结论中正确的是
A.若混合溶液的pH等于7,则c1V1==c2V2
B.若V1==V2,c1==c2,则溶液中c(NH4+)== c(Cl-)
C.若混合溶液的pH等于7,则溶液中c(NH4+)>c(Cl-)
D.若V1==V2,且混合液的pH小于7,则可能有c1== c2
11.下列叙述中正确的是 ( )
①标准状况下,1LHCl和1LH2O的物质的量相同;②标准状况下,1gH2和14gN2的体积相同;③28gCO的体积为22.4L;④两种物质的物质的量相同,则它们在标准状况下的体积也相同;⑤在同温同体积时,气体物质的物质的量越大,则压强越大;⑥同温同压下,气体的密度与气体的相对分子质量成正比。
A.仅①②③ B.仅②⑤⑥ C.仅②③⑥ D.仅④⑤⑥
10.分别燃烧下列各组物质中的两种有机化合物,所得CO2和H2O的物质的量之比相同的是
A.乙烯、乙炔 B.乙醇、乙醚(C2H5-O-C2H5)
C.甲苯、乙苯 D.乙酸、丁醛
9.下列说法正确的是
A.金属元素的最高价氧化物对应的水化物都是碱
B.ⅥA族元素的氢化物中稳定性最好的,其沸点也最高
C.同一主族的元素,原子半径越大其单质的熔点越高
D.全部由非金属元素形成的化合物不可能是离子化合物
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com