
题目列表(包括答案和解析)
3.在一定浓度BaCl2溶液中通入SO2气体未见产生沉淀,若先通入一种气体,再通入SO2,则有白色沉淀,这种气体不可能是 ( )
A.NH3 B.CO2 C.NO2 D.Cl2
2.已知热化学方程式:2H2O(g)=2H2(g)+O2(g);△H=+483.6kJ/mol,2H2(g)+O2
(g)=2H2O(l);△H=-571.6kJ/mol,当18g液态水变为气态水时,△H为 ( )
A.△H=-88kJ/mol B.△H=+88kJ/mol
C.△H=-44kJ/mol D.△H=+44kJ/mol
1.俄罗斯科学家最近合成出第114号元素的一种原子,该原的质量数为289,则该原子的中子数和电子数之差为 ( )
A.61 B.114 C.175 D.289
28.已知Cl2通入浓氨水中会发生如下反应:3Cl2+8NH3=6NH4Cl+N2。含有体积为1.12L,质量为3.335g的Cl2和N2的混合气体通过浓氨水后,体积为0.672L[其中Cl2和N2各占50%(体积分数)]。(气体体积均为标准状况下测定)。
(1)经计算,被氧化的NH3的质量为 (不用写计算过程)。
(2)下面是三位学生从不同角度解这道题时所列的第一步算式,请判断他们所列未知数
X分别表示什么量,并填写在表格内:(单位没列出)
|
学生编号 |
所列第一步算式 |
未知数X表示的意义 |
|
甲 |
(3-1):2=(1.12-0.672)/22.4:X |
|
|
乙 |
3:(X-0.672/2)=1:[0.672/2-(1.12-X) |
|
|
丙 |
71X+28(1-X)=(3.335/1.12)×22.4 |
|
哈尔滨市第九中学2006届高三10月份月考试题
 27.纯碱中含有少量的NaCl等杂质,利用下列仪器装置可用来测定纯碱中的Na2CO3的质量百分含量(即质量分数)。
27.纯碱中含有少量的NaCl等杂质,利用下列仪器装置可用来测定纯碱中的Na2CO3的质量百分含量(即质量分数)。
图中:1.空气 2.某溶液 3.纯碱 4.稀H2SO4 5.碱石灰
其实验步骤是:
a.按上图所示,组装好实验仪器,并检查其气密性
b.准确称取盛有石灰的干燥管D的质量(设为m1g)
c.准确称取一定量的纯碱(设为ng),并将其放进广口瓶内
d.从分液漏斗中缓缓滴入一定量的稀硫酸,并从“1”处缓缓鼓入空气,至B反应器中不再产生气体为止
e准确称取干燥管D的总质量(设为m2g)
根据上述实验,回答下列问题:
(1)该实验进行到操作d时,要缓缓鼓入空气,鼓入空气的作用是 。
装置A中盛装的液体“2”应选用 ;装置A的作用是 ;如果
撤去装置A,直接向装置B中缓缓鼓入空气,则会导致实验结果
(填偏大、偏小或不变)。
(2)在空白格内画出装置C及试济“5”是 ;说明装置C的作用是
;如果撤掉装置C,则会导致实验测定结果
(填偏大、偏小或不变)。
(3)根据此实验,计算出纯碱中Na2CO3的质量百分含量(即质量分数)的数学式为
(用m1、m2、n表示)。
(4)装置E的作用是 。
26.室温下,单质A、B、C分别为固体、黄绿色气体、无色气体,在合适反应条件下,它们可以按下面框进行反应。又知E溶液是无色的。请回答:

(1)A是 B是 C是 。(请填化学式)
(2)反应③的化学方程式: 。
(3)反应④的离子方程式: 。
25.某溶液中含有SO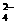 、CO
、CO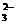 、OH-、Cl-,若只允许取一次该溶液而把四种离子分别检验出来,则应该采取什么样的措施(能写出离子方程式的,写出每检验出一种离子后的离子方程式)
、OH-、Cl-,若只允许取一次该溶液而把四种离子分别检验出来,则应该采取什么样的措施(能写出离子方程式的,写出每检验出一种离子后的离子方程式)
(1)先检验 ;加入 试剂(或溶液),离子方程式
(2)然后检验 ;加入 试剂(或溶液),离子方程式
(3)再检验 ;加入 试剂(或溶液),离子方程式
(4)最后检验 ;加入 试剂(或溶液),离子方程式
24.配平下面反应方程式并用单线桥和双线桥(第一个用单线桥,第二个用双线桥)标出电子转移的方向和数目。
①
 □MnO
□MnO +□ H2O2+□H+ Mn2+
+ □O2 +□H2O
+□ H2O2+□H+ Mn2+
+ □O2 +□H2O
②(已知AgClO3和O2的物质的量之比为1:1)
 □AgF+□Cl2+□H2O □AgCl+□AgClO3+□O2+□HF
□AgF+□Cl2+□H2O □AgCl+□AgClO3+□O2+□HF
23.在反应3BrF3+5H2O=HbrO3+Br2+9HF+O2中,当有3mol水参加反应时,由BrF3还原的BrF3为 mol;总共转移的电子数为 mol。
22.将2mol NaHCO3和一定量的Na2O2固体混合,在加热条件下其充分反应后的固体,经测定Na2O2无剩余,则最后的固体的物质的量为 ( )
A.1~4mol之间 B.1~2mol之间 C.2~4mol之间 D.大于4mol
第Ⅱ卷(非选择题共44分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com