
题目列表(包括答案和解析)
1.主族元素A有1个价电子,主族元素B的最高价与最低价的绝对值相等,它们形成化合物的化学式是( )
(A)AB4 (B)BA4 (C)A2B (D)B2A3
4.从不同角度对化学反应进行分类及相对应的表示方式
|
分类角度 |
反应类型 |
表示方法 |
|
基本反应类型 |
分解反应、化合反应、置换反应、复分解反应 |
化学方程式 |
|
有无电子转移 |
氧化还原反应、非氧化还原反应 |
氧化还原反应方程式(单线桥法、双线桥法) 半反应(原电池反应和电解反应中的电极反应) |
|
是否有离子参加 |
离子反应、分子反应 |
离子方程式 |
|
反应程度大小 |
可逆反应、不可逆反应 |
可逆符号 |
|
按热效应分 |
吸热反应、放热反应 |
热化学方程式 |
[典型题析]
[例1]下列各组物质中不易用物理性质区别的是( )。
(A)苯和四氯化碳 (B)酒精和汽油
(C)氯化铵和硝酸铵晶体 (D)碘和高锰酸钾固体
[解析]苯的密度小于1 g·cm-3 ,四氯化碳的密度大于1g·cm-3,两种液体都不溶于水,利用这一点可用水区别。酒精能以任意比与水混溶,汽油不溶于水,用水可以区别。碘微溶于水,碘水溶液显黄褐色溶液,高锰酸钾易溶于水,水溶液显紫红色。氯化铵与硝酸铵的色、态和溶解性很相近,不易用物理性质加以区分。答案选C。
[例2]某些化学试剂可用于净水。净水处理中使用的一种无机高分子混凝剂的化学式可表示为[Al2(OH)nClm·yH2O]x,式中m等于( )
(A)3-n (B)6-n (C)6+n (D)3+n
[解析]显然,这种无机高分子中各元素的化合价之和应等于零。[Al2(OH)nClm·yH2O]x中可看成是Al3+、OH-、Cl-、H2O四部分组成,所以必有m=6-n。答案选B。
[例3]下列物质中属于离子化合物的是( )
A.苛性钠 B.碘化氢 C.硫酸 D.醋酸
[解析]苛性钠就是氢氧化钠,氢氧化钠属于离子化合物。碘化氢、硫酸、醋酸都是共价化合物。
[例4]单质铁溶于一定浓度的硝酸中反应的化学方程式如下:
a Fe+b NO3-+c H+==d Fe2++f Fe3++g NO↑+h N2O↑+k H2O(化学计量数均为正整数)
请你用已掌握的知识研究出下列规律。
(1)c、g、h的关系式是______________________________。
(2)b、c、d、f的关系式是_________________________________________。
(3)d、f、g、h的关系式是__________________________________________。
(4)若a =12,铁和硝酸恰好完全反应,则b的取值范围是_______________________。c的取值范围是____________________ __。
[解析](1)这是考查反应前后H、O原子守恒关系。若只从“c H+ g NO+h N2O”去分析,似乎H+跟NO、N2O之间没有什么联系,思路不容易展开。只要抓住“反应中H+全部转化为H2O”、“NO和N2O全是由NO3-转变而来”,必有“NO3-
g NO+h N2O”去分析,似乎H+跟NO、N2O之间没有什么联系,思路不容易展开。只要抓住“反应中H+全部转化为H2O”、“NO和N2O全是由NO3-转变而来”,必有“NO3-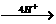 NO+2H2O”和“2NO3-
NO+2H2O”和“2NO3-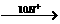 N2O+5H2O”,进而总结出“c= 4g+10h”。
N2O+5H2O”,进而总结出“c= 4g+10h”。
(2)这是考查离子电荷守恒关系。离子反应中反应物微粒所带的电荷数和生成物微粒所带的电荷数必定相等。b、c、d、f 恰好是反应方程式中各种离子的化学计量数,因此根据“b NO3-+c H+ d Fe2++f Fe3+”就可计算出“c-b=2d+3f”。
d Fe2++f Fe3+”就可计算出“c-b=2d+3f”。
(3)这是是考查电子守恒关系。d、f、g、h恰好是与电子得失有关四种产物的化学计量数,其中“d Fe2++f Fe3+”决定失电子总数,“g NO+h N2O”决定得电子总数,所以有“2d+3f=3g+8h”。
(4)可以用极限思维方法来解决。这里要注意三个前提:一是a =12;二是铁和硝酸恰好完全反应;三是每种物质的化学计量数均为正整数(即产物中既要有Fe2+、又要有 Fe3+,既要有NO、又要有N2O)。有12molFe完全反应时,只有当“Fe Fe2+、NO3-
Fe2+、NO3- N2O”时消耗的NO3-最少(计算可得需6mol),只有当“Fe
N2O”时消耗的NO3-最少(计算可得需6mol),只有当“Fe Fe3+、NO3-
Fe3+、NO3- NO”时消耗的NO3-最多(计算可得需12mol),所以有“6<b<12”。从分析问题(1)的基础上可得出,有12molFe完全反应时,只有当“Fe
NO”时消耗的NO3-最多(计算可得需12mol),所以有“6<b<12”。从分析问题(1)的基础上可得出,有12molFe完全反应时,只有当“Fe Fe2+、NO3-
Fe2+、NO3- N2O”时消耗的H+最少(计算可得需30mol),只有当“Fe
N2O”时消耗的H+最少(计算可得需30mol),只有当“Fe Fe3+、NO3-
Fe3+、NO3- NO”时消耗的H+最多(计算可得需48mol),所以有“30<c<48”。
NO”时消耗的H+最多(计算可得需48mol),所以有“30<c<48”。
[评注]各个子问题间跨度较大,要求解题者每答完一个问题就要转换到另一个新的思维角度、跳跃到另一个知识背景中去分析研究,有的学生就是因为思维的灵活性不够、思维的慎密性不强,造成思路阻塞。
[例5] A、B、C是在中学化学中常见的三种化合物,它们各由两种元素组成,甲、乙是两种单质。这些化合物和单质之间存在如下的关系:
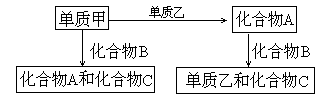
据此判断:
(1)在A、B、C这三种化合物中,必定含有乙元素的是 。(用A、B、C字母填写)。
(2)单质乙必定是 (填“金属”或“非金属”),其理由是 。
(3)单质乙的分子式可能是 ,则化合物B的分子式是 。
[解析]试题主要考查利用化学基本概念进行抽象分析能力。
(1)观察题给转化关系图可推出:第一,化合物A由单质甲和单质乙化合而成,其中必含有乙元素;第二,单质甲跟化合物B反应可生成A和C,说明化合物B中必定含有元素乙;第三,无法确定化合物C中是否含有乙元素。所以答案为A、B。
(2)联系常见非金属元素、金属元素化合物的化学规律可推出,单质乙必定是非金属元素。因为A+B→乙+C,且乙为单质,可知乙元素在A、B中分别呈正、负价,而金属元素只显0价和正价,非金属元素可显负价、0价和正价。所以乙是非金属。
(3)从中学化学知识范围考虑可联想到硫化氢跟二氧化硫、氨气跟氮的氧化物等物质间的反应,从而可推测单质乙可能是硫、氮气等。所以答案为S,H2S(或:N2,NH3)。
[考题预测与专题训练]
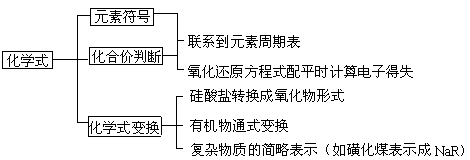
3.化学式、化合价等综合应用
2.可以从不同角度对物质进行分类
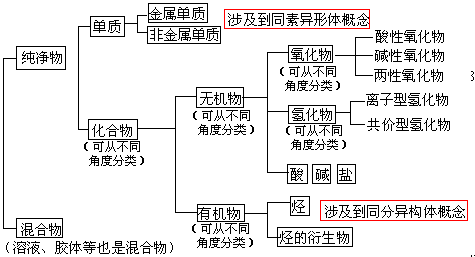
化学复习中要注意从不同角度分析梳理有关问题。如可以从多种角度对物质进行分类。
1.原子、分子、离子都是保持化学性质的一种微粒
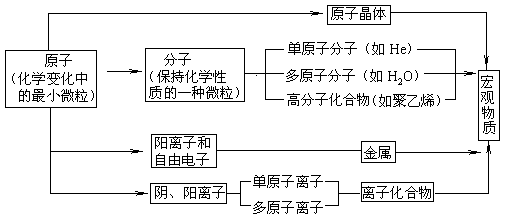
3.相对原子质量、相对分子质量、物质的量,气体摩尔体积等重要基本概念,无论是化学概念辩折题还是化学计算题中必须要用到这些重要概念。
[知识体系和复习重点]
2.无论是基础型试题还是能力型试题,问题的答案大多会要求考生用化学方程式、离子方程式、热化学方程式、化学式、结构简式等基本化学用语来表述答案,每年的高考化学试题的答案中化学用语占有很大的比例。可以说,熟练掌握化学用语、理解这类化学用语的含义非常重要。
1.高考试题中常用选择题来考查考生对同素异形体、同分异构体、同位素和核素、无机反应和有机反应的分类、化合价、原子结构等基本概念的理解程度。高考中常会以化学学科中的重要概念来考测考生对化学基础概念的理解和辩折能力。
19、下列溶液,一定呈中性的是 CD
A.C(H+)=1×10- 7mol·L-1的溶液 B.pH=14-pOH的溶液
C.C(H+)=C(OH-)=1×10-6mol·L-1的溶液 D.pH= pOH的溶液
18、下表是几种物质在不同温度下的溶解度,工业上将等物质的量的NaCl、CO2、NH3溶于水中,在30℃时配成溶液,此时溶液无晶体,当降致某温度时,开始析出晶体。此晶体是 B
|
温度 物质 |
0℃ |
10℃ |
20℃ |
30℃ |
|
NH4Cl |
29.4g |
33.3g |
37.2g |
41.1g |
|
NH4HCO3 |
11.9g |
15.9g |
21.0g |
27g |
|
NaHCO3 |
6.9g |
8.15g |
9.6g |
11.1g |
|
NaCl |
35.7g |
35.8g |
36g |
36.4g |
A、NaCl B、NaHCO3 C、NH4Cl D、NH4HCO3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com