
题目列表(包括答案和解析)
5.将0.1 mol N2O4置于密闭烧瓶中,把烧瓶放入100 ℃的恒温水浴,烧瓶内的气体逐渐变为红棕色:N2O4(g) 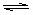 2NO2 (g),能说明反应在该条件下达到平衡的是
2NO2 (g),能说明反应在该条件下达到平衡的是
① N2O4的消耗速率与NO2的生成速率之比为1∶2;
② 烧瓶内气体的质量和密度不再变化;
③烧瓶内气体的压强不再变化;
④烧瓶内气体的平均相对分子质量不再变化
A.①② B.②③ C.③④ D.②③④
4.2005年诺贝尔化学奖授予在“烯烃复分解反应”研究方面作出贡献的三位科学家。“烯烃复分解反应”是指在催化剂的作用下,碳碳双键断裂并重新组合的过程。如两分子烯烃
RCH=CHR′在催化剂作用下会生成两种新的烯烃RCH=CHR和R′CH=CHR′,若用CH2=CHCH2CH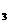 和CH2=
和CH2=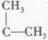 发生“烯烃复分解反应”,生成新烯烃的产物有
发生“烯烃复分解反应”,生成新烯烃的产物有
A.3种 B. 4种 C. 5种 D. 6种
3.下列说法或表示方法中正确的是
A.由 C(金刚石)→C(石墨) ;ΔH = +119 kJ/mol 可知金刚石比石墨稳定
B.等质量的硫固体和硫蒸气分别完全燃烧,前者放出的热量多
C.常温下,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,其热化学方程式为:
2H2(g) + O2(g) = 2H2O(l);ΔH = -285.8 kJ/mol
D.热化学方程式中化学计量系数表示分子个数
2.向盛有一定量水的甲乙两试管分别通入SO2气体至饱和,若向甲试管加入足量稀硝酸,乙试管加入足量氢氧化钠溶液,下列叙述正确的是
A.甲中没有沉淀生成,乙中生成BaSO3沉淀 B.甲、乙都有BaSO3沉淀生成
C.甲、乙都没有沉淀生成 D.甲、乙分别生成BaSO4和BaSO3沉淀
1.有人建议将氢元素排在周期表的ⅦA族。能支持这一观点的是:①氢原子得一个电子实现最外
电子层稳定结构;②单质分子中原子间的化学键都是非极性键;③氢元素与碱金属元素可形成离子化合物M+ [∶H]-
A.①② B.②③ C.①③ D.①②③
26.2.80g铁与100mL稀硝酸混合后充分反应,产生气体为NO,反应后铁、硝酸均无剩余。向反应后的溶液中加入100mL0.2mol/L的碘化钾溶液,恰好将溶液中的Fe3+全部还原,求原硝酸溶液的物质的量浓度。
25.(1)将mg铁粉和ng硫粉均匀混合,在密闭容器中加热到红热,冷却后加入多少毫升bmol/L的盐酸就不再产生气体?(用含m和b的代数式表示)若把已放出的气体收集起来,在标准状况下的体积一共是多少升?
(2)若把0.1mol 铁粉和1.6g硫粉均匀混合后,铺在石棉网上用酒精灯加热引燃,完全反应后,将残渣全部放入过量的稀H2SO4中充分反应,结果所产生的气体体积在标况下明显少于2.24L,其简述原因 。
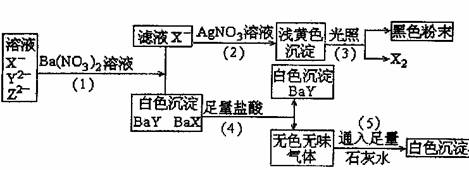 24.某溶液中含有X-、Y2-、Z2-三种常见的无机离子,如下图所示,发生了一些化学反应:
24.某溶液中含有X-、Y2-、Z2-三种常见的无机离子,如下图所示,发生了一些化学反应:
(1)判断X-、Y2-、Z2-分别为(写离子符号) 、 、
(2)写出①、②、③、④、⑤各步反应的化学方程式或离子方程式。
①
②
③
④
⑤
 22.在MgCl2溶液中加入适量的氨水,有白色沉淀生成,再在白色沉淀中加入较浓的NH4Cl溶液,白色沉淀又溶解,请对此现象作出合理的解释(用离子方程式表示)
22.在MgCl2溶液中加入适量的氨水,有白色沉淀生成,再在白色沉淀中加入较浓的NH4Cl溶液,白色沉淀又溶解,请对此现象作出合理的解释(用离子方程式表示)
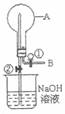
23.如图所示,在烧瓶中充满气体A,打
开活塞①向烧瓶中缓慢通入等体积的
气体B后关闭①,待充分反应后再打
开止水夹②。请按要求填写下表。
|
实验 序号 |
气体A |
气体B |
现 象 |
A与B反应的学方程式 |
|
|
打开止水 夹②前 |
打开止水 夹②后 |
||||
|
① |
SO2 |
H2S |
|
|
|
|
② |
O2 |
NO |
|
|
|
21.在一定条件下,某元素的氢化物X可完全分解为两种单质:Y和Z。若已知:①反应的X与反应后生成的Z的物质的量之比n(x):n(z)=2:3 ②单质Y的分子为正四面体构型。请填写下列空白:
(1)单质Y是 ,单质Z是 (填写名称或分子式)。
(2)Y分子中共含 个共价键。
(3)X分解为Y和Z的化学方程式为:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com