
题目列表(包括答案和解析)
24、(11分)我国第二代居民身份证采用具有绿色环保性能的PETG新材料,它可以回收再利用,而且对周边环境不构成任何污染。PETG的结构简式为: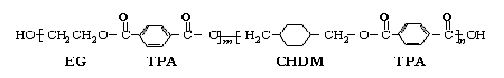
已知:
(1)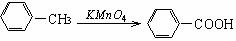
(2)RCOOR1 +R2OH  RCOOR2 +R1OH (R、R1、R2表示烃基)
RCOOR2 +R1OH (R、R1、R2表示烃基)
可采用下列合成这种材料路线:
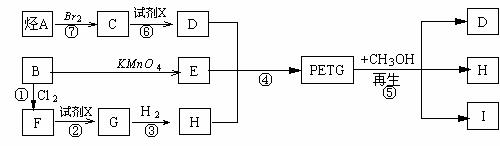
(1)反应②⑥的试剂X是 ;反应①的条件 ;(2)反应④的类型 ;
(3)写出结构简式:F ;I ;
(4)合成时应控制的单体的物质的量之比为:
n(D)∶n(E)∶n(H)= ∶ ∶ (用m、n表示);
(5)写出反应⑥的化学方程式:
_____ 。
23.(14分)由白色和黑色固体组成的混合物A,可以发生如图所示的一系列变化:
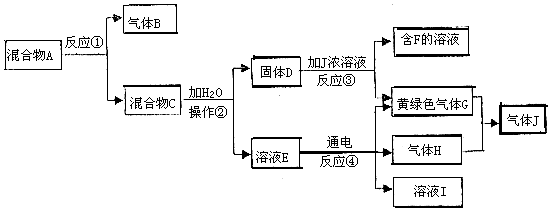
(1)反应③的化学方程式: ;
反应④的离子方程式: ;
(2)操作②的名称是 ,操作②中使用的玻璃仪器的名称 。
(3)下列装置中可用于制取气体G的发生装置是 ;为了得到纯净干燥的气体G,可将气体通人c和d装置,c装置中装的试剂是 ,d装置中装的试剂是浓硫酸。
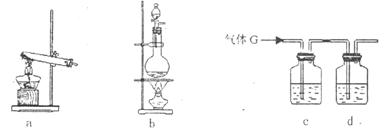
(4)为防止污染环境,必须将尾气进行处理,请写出用烧碱溶液吸收气体有毒G的离子方程式: ;
用过量的固体粉末D和一定量的J的浓溶液,在加热的条件下反应,所得气体G的体积比较理论值稍小的原因可能是 ;
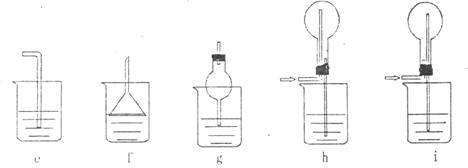
(5) 气体J极易溶于水,为防止倒吸,下列装置中,不可以用于吸收J的是 。
22. (10分) 已知;
(10分) 已知;
RCH=CH2 RCH(CH3)CHO
|
 (CH3)2
CHCOOR
CH2=C(CH3)
COOR
(CH3)2
CHCOOR
CH2=C(CH3)
COOR
A是含碳87.8%的直链烃,相同条件时,其气体对氢气的相对密度为41,B─F为烃的含氧衍生物,它们有以下转化关系:
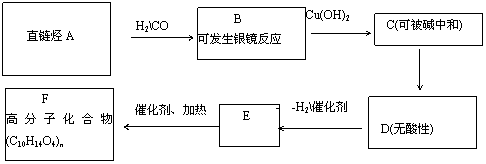
CH3OH、浓硫酸、△
(1) 写出A、E、F的结构简式A: ;E : ;F: ;
(2) 写出B发生银镜反应的离子方程式 . ;
(3)  写出C
D反应的化学方程式:
;
写出C
D反应的化学方程式:
;
21.(11分)空气吹出法工艺,是目前“海水提溴”的最主要方法之一。其工艺流程如下:

(1) 溴在周期表中位于_________周期,_________族。
(2) 步骤①中用硫酸酸化可提高Cl2的利用率,为什么?
____________________________________ 。
(3) 步骤④的离子方程式:____________________________________________ 。
(4) 步骤⑥的蒸馏过程中,溴出口温度为何要控制在80-900C。温度过高或过低都不利于生产 ,请解释原因:__________________________________________________ 。
(5) 步骤⑧中溴蒸气冷凝后得到液溴与溴水的混合物,可利用它们的相对密度相差很大的特点进行分离。分离仪器的名称是_____________,分离时液溴从分离器的_____(填“上口”或“下口”)排出。
(6) 为什么不直接用含溴的海水进行蒸馏得到液溴,而要经过“空气吹出、SO2吸收、氯化”:
。
20.(6分) 某学生为了将含有少量杂质(铜粉)的氯化铁提纯,拟定以下实验步骤:a.把样品加水溶解,b.过滤 c.把滤液加热蒸干,得到FeCl3固体,试回答:
(1) 以上设计 科学的(填是或不是),理由是
。
(2) 请你设计和完善提纯FeCl3的方案:.
①把样品加水溶解 , ② ,③过滤, ④ ,
⑤ ,⑥把滤液加热蒸发结晶,得FeCl3固体。
19.若仅有下列仪器:烧杯、铁夹、铁架台、铁圈、三角架、泥三角、分液漏斗、石棉网、酒精灯、玻璃棒、量筒、蒸发皿、冷凝管、温度计、胶塞、锥形瓶,牛角管、玻璃导管、圆底烧瓶,从缺少的仪器看来,不能进行实验的项目是
A.分离CCl4(沸点为76.75℃)和甲苯(沸点为110.6℃)的混合物
B.氢氧化铁胶体的制备
C.分离水和汽油的混合物
D.配制一定物质的量浓度的溶液
19.铁粉和铜粉的均匀混合物,平均分成四等份,分别加入同浓度的稀硝酸,充分反应,在标准状况下生成NO的体积和剩余金属的质量如下表(设硝酸的还原产物只有NO):
|
编号 |
① |
② |
|
稀硝酸体积/mL |
100 |
200 |
|
剩余金属/g |
18.0 |
9.6 |
|
NO体积/mL |
2240 |
4480 |
下列计算结果正确的是
A.硝酸的浓度为4 mol/L B.①中溶解了5.6 g Fe
C.④中V=8960 D.②中溶解了9.6 g Cu
18.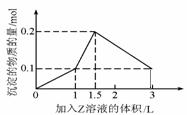 某混合溶液中含溶质X、Y的量都为0.1
mol,向其中滴加溶液Z(0.1 mol·L-1氢氧化钠或硫酸溶液)至溶液呈中性,所得沉淀的物质的量与加入Z溶液的体积关系如图,则X、Y、Z分别是
某混合溶液中含溶质X、Y的量都为0.1
mol,向其中滴加溶液Z(0.1 mol·L-1氢氧化钠或硫酸溶液)至溶液呈中性,所得沉淀的物质的量与加入Z溶液的体积关系如图,则X、Y、Z分别是
A. 偏铝酸钠、氯化钡、硫酸
B. 偏铝酸钠、氢氧化钡、硫酸
C. 氯化铝、氯化铁、氢氧化钠
D. 氯化铝、氯化钠、氢氧化钠
17. 一定温度下,将2 mol SO2和1 mol O2混合于体积可变的密闭容器中,发生反应:2SO2(g) + O2(g)
一定温度下,将2 mol SO2和1 mol O2混合于体积可变的密闭容器中,发生反应:2SO2(g) + O2(g) 2SO3(g);ΔH<0,平衡混合气体的总物质的量为2.1 mol,体积为0.5 L,下列说法正确的是
2SO3(g);ΔH<0,平衡混合气体的总物质的量为2.1 mol,体积为0.5 L,下列说法正确的是
A.SO2的平衡浓度为0.2mol·L-1
B.达到上述平衡时,SO2的转化率为90%
C. 若升高温度,重新达到平衡时,混合物气体的总物质的量 >2.1 mol
D.若温度不变,起始加入0.6 mol SO2、0.3 mol O2和x mol SO3,平衡时
各气体的体积分数与上述平衡状态相同,x的值一定为 1.4 mol
16.下列离子方程式正确的是
A. FeO与稀HNO3反应:FeO + 2H+ = Fe2+ + H2O
B.石灰石溶于醋酸:CaCO3+2H+=Ca2+ + CO2↑+ H2O
C.向Ba(OH)2
溶液中逐滴加入NaHSO4稀溶液至刚好沉淀完全:
Ba2++OH-+ H+ + SO = BaSO4↓+ H2O
= BaSO4↓+ H2O
D.向NaAlO2溶液中滴加过量的稀盐酸: AlO2-+ 4H+ = Al3++2H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com