
题目列表(包括答案和解析)
8.类推的思维方法在化学学习和研究中常会产生错误的结论,因此类推出的结论最终要经过实践的检验才能决定其正确与否。下列几种类推结论中不正确的是
A.Mg失火不能用CO2灭火;Na失火也不能用CO2灭火
B.Fe3O4可写成FeO·Fe2O3;Pb3O4也可写成2PbO·PbO2
C.不能用电解熔融AlCl3来制取金属铝;也不用电解熔融MgCl2来制取金属镁
D.Fe与S直接化合生成FeS;Cu与S直接化合也可以得到Cu2S
7.下列离子方程式不正确的是
A.NaHS溶液中通入足量氯气:HS-+Cl2 ==S↓+H++2Cl-
B.用碳酸钠溶液吸收少量二氧化硫气体:2CO32-+SO2+H2O ==2HCO3-+SO32-
C.硫化钠溶于水中:S2-+2H2O  H2S↑+2OH-
H2S↑+2OH-
D.将少量氯气通入溴化亚铁溶液中:2Fe2++Cl2==2Fe3++2Cl-
6.设NA表示阿伏加德罗常数,下列说法中正确的是
A.1mol甲基正离子(CH3+)所含电子数为8NA
B.在反应CaO+3C高温CaC2+CO↑中,若生成1molCO,则转移电子数为3 NA
C.由2H和18O所组成的水11g,其中所含的中子数为5NA
D.SiO2晶体中,1mol硅原子形成2NA个Si-O共价键
5.硝酸铵(NH4NO3)在不同条件下分解可以得到不同的产物,下列各组物质中肯定不可能是硝酸铵分解产物的是
A.N2O、H2O B.N2、O2、H2O C.N2、HNO3、H2O D.NH3、NO、H2
4.已知NaHSO3溶液呈酸性、NaHCO3溶液呈碱性。现有浓度均为0.1 mol·L-1的NaHSO3溶液和NaHCO3溶液,溶液中各粒子的物质的量浓度存在下列关系(R表示S或C),其中一定正确的是
A.c(Na+)>c(HRO3-)>c(H+)>c(RO32-)>c(OH-)
B.c(Na+)+c(H+)=c(HRO3-)+c(RO32-)+c(OH-)
C.c(H+)+c(H2RO3)=c(RO32-)+c(OH-)
D.两溶液中c(Na+)、c(HRO3-)、c(RO32-)分别相等
3.居室装修用石材的放射性常用 作为标准,居里夫人(Marie Curie)因对Ra元素的研究两度获得诺贝尔奖。下列叙述中正确的是
作为标准,居里夫人(Marie Curie)因对Ra元素的研究两度获得诺贝尔奖。下列叙述中正确的是
A.一个 原子中含有138个中子 B.Ra元素位于元素周期表中第六周期ⅡA族
原子中含有138个中子 B.Ra元素位于元素周期表中第六周期ⅡA族
C.RaCl2的熔点比CaCl2高 D.Ra(OH)2是一种两性氢氧化物
txjy
2.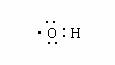
 下列化学用语表示错误的是
下列化学用语表示错误的是
A.次氯酸电子式 B.羟基电子式

 C.镁离子结构示意图
D.氨分子结构
C.镁离子结构示意图
D.氨分子结构
txjy
1.旨在限制发达国家温室气体排放量、抑制全球范围内气候持续变暖的《京都议定书》随着俄罗斯的加入,于2005年2月16日正式生效。我国二氧化碳的排放量位居世界第二,为减少二氧化碳这种温室气体的排放,下列措施不切实际的是
A.大力开发氢能源 B.充分利用太阳能
C.不使用含碳能源 D.提高能源利用率
txjy
21、(8分)将一定量的铝和氧化镁样品溶于30mL 1mol/L稀硫酸中,样品完全溶解,向该溶液中逐滴加入氢氧化钠溶液,生成沉淀情况如图所示。试回答:
(1)当达到最大沉淀时,所用氢氧化钠溶液的体积为 ml,此时,溶液中的溶质为 。
(2) NaOH溶液的浓度为:
(3)原样品中铝和氧化镁的物质的量分别为多少?
(4)当生成的沉淀为1.5m时,所加NaOH溶液的体积为多少?

20、(12分)某校化学小组学生利用下图所列装置进行“铁与水反应”的实验,并利用产物进一步制取FeCl3·6H20晶体。(图中夹持及尾气处理装置均已略去)
 (1)装置B中发生反应的化学方程式是
。
(1)装置B中发生反应的化学方程式是
。
(2)装置E中的现象是 。
(3)停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤。简述检验滤液中Fe3+的操作方法: 。
(4)该小组学生利用上述滤液制取FeCl3.6H20晶体,设计流程如下:
滤液 FeCl3溶液 FeCl3.6H20晶体
①步骤I中通入C12的作用是 。
②步骤II从FeCl3稀溶液中得到FeCl3﹒6H20晶体的主要操作包括:
③该流程中需保持盐酸过量,主要原因是(结合离子方程式简要说明):
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com