
题目列表(包括答案和解析)
4.常温下,下列各组物质不能用一种试剂通过化学反应区别的是
A.MnO2 CuO FeO B.Na2CO3 NaHCO3 K2CO3
C.AgNO3 KNO3 Na2CO3 D.(NH4)2SO4 K2SO4 NH4Cl
3. 用惰性材料作电极,分别电解下列物质,当通过相同电量时,下列指定的电极上析出气体质量最大的是
A.NaOH溶液(阴极) B.NaCl溶液(阴极)
C.熔融的NaCl(阳极) D.Na2SO4溶液(阳极)
2.接触法生产H2SO4过程,对废气、废水、废渣、“废热”的处理正确的是
①尾气用氨水处理;
②污水用石灰乳处理;
③废渣用来造水泥,炼铁;
④设置“废热”锅炉产生蒸气,供热或发电
A.只有①② B.只有①③④ C.只有①②③ D.全部
1.下列说法正确的是
.... A.NaCl溶液、MgCl2溶液、KNO3溶液、Al2(SO4)3溶液可以用一种试剂加以区别
B.合成氨工业与接触法制硫酸中SO2催化氧化的过程中都采用了高压的生产条件
C.在医院中为酸中毒病人输液不应采用0.9%氯化铵溶液
D.汽车排放的尾气中含有氮氧化物的主要原因是汽油燃烧不充分引起的
25.(12分)图(甲)是实验室用氢气还原氧化铜实验的微型快速实验装置.其中的粗铜丝“Ⅰ”可以在试管M中上下移动,实验前先将铜丝“Ⅰ”处理成下端弯曲的一小圆环,并用铁锤击成带小孔的小匙,虚线框中需连入图(乙)(仪器上下端位置固定)的某装置进行实验.图乙中的细铜丝“Ⅱ”一端被弯成螺旋状.
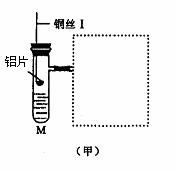
(1)在图甲中,试管M中的液体应选用_____________________________ __.
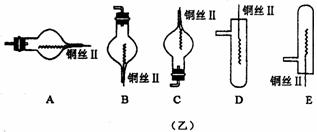
(2)在图示的虚线框中应连入的最合适的装置是________(填代号)
(3)上述制氢气的方法与将铝片直接加入试管中相比,其优点有_________ _______
______________________________________________________________________.
(4)实验过程中,在试管M中可观察到的现象是________________ _____________
_______________________________________________________________________
___________________________________________________________.
(5)实验时,细铜丝“Ⅱ”的操作方法是________________ ____________________
______________________________________________________________________
__________________________________________.
(6)若实验室无粗铜丝,而改用无锈粗铁丝,为让其反复使用,则此时M中的液体为
________;发生反应的离子方程式为__________________________________.
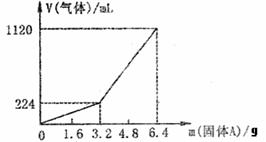 26.(8分)将一定量的混合均匀的铁粉和硫粉在隔绝空气的条件下共热,充分反应后冷却至室温,得到固体A。将质量为m的固体A加入到300mL 2mol·L-1盐酸中使之完全溶解,测得室温下加入的固体A的质量与收集到的气体体积(已换算成标准状况)的关系如图,(假设氢硫酸溶液饱和之前无硫化氢逸出)。
26.(8分)将一定量的混合均匀的铁粉和硫粉在隔绝空气的条件下共热,充分反应后冷却至室温,得到固体A。将质量为m的固体A加入到300mL 2mol·L-1盐酸中使之完全溶解,测得室温下加入的固体A的质量与收集到的气体体积(已换算成标准状况)的关系如图,(假设氢硫酸溶液饱和之前无硫化氢逸出)。
已知加入固体A的质量m≤3.2g时,收集到的气体为氢
气,当m>3.2g时收集到的气体为氢气和硫化氢的混合气。
试分析与计算:
(1)3.2g固体A中所含的物质有
(写化学式) 。
(2)3.2g固体A中各物质的物质的量分别为 。
溶于上述盐酸充分反应后,所得的溶液中氢硫酸的物质的量浓度为(忽略体积变化) 。
(3)当固体A全部溶于上述盐酸,且A的质量m>3.2g时,收集到的气体体积(标准状况下)V= mL。(用含m的代数式)
24.(8分)(2005年广东卷)下图中,A、C是工业上用途很广的两种重要化工原料,B为日常生活中常见的金属,H、G是正四面体结构的非极性分子,H是一种重要的能源,J是一种耐高温材料,K是由两种常见元素组成的化合物(图中部分反应物或生成物没有列出)。
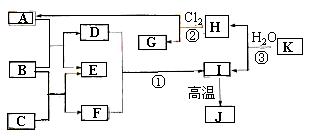
请按要求回答:
(1)写出B的化学式_______________,
G的电子式_________________。
(2)反应①的离子方程式为_______________________________________。
(3)反应③的化学方程式为________________________________________。
23.(6分)已知某溶液中只含有4种离子:A+、B-、H+、OH-,对这4种离子浓度的大小比较,有以下3种说法。请判断离子浓度的大小顺序是否正确,你认为正确的请在相应的空格内填上符合这种情况的A+和B-组成物质的化学式(只写一种情况,可以是一种溶质或两种溶质);你认为一定不正确的,请在相应的空格内填上你选择“不正确”的理由。供选择的离子有:Na+、Ag+、NH4+、Cl-、NO3-、CH3COO-、H+、OH-
(1)c(B-)>c(A+)>c(H+)>c(OH-):
(2)c(A+)>c(B-)>c(OH-)>c(H+):
(3)c(H+)>c(B-)>c(A+) >c(OH-):
22.(10分)以石墨做电极电解200mL 0.5mol/L的CuSO4溶液,在标准状况下,阴极上收集到2.24L气体时,停止通电。请回答下列问题:
(1)电解过程中阴极的电极反应式为 、 ;(2分)
(2)电解过程中共收集到气体的体积为 ;
(3)若电解前后溶液的体积变化忽略不计,电解后溶液的pH值约为 ;
(4)电解结束后,欲使溶液恢复到电解前溶液的组成和浓度,可加入 mol ;(2分)
(5)电解时的电流强度为20安培,理论上所需电解时间为 分。(设1mol电子的电量为96500库仑)
21.(6分)下列三组试剂已失去标签,分别用一种试剂可以鉴别。
A、AlCl3、NaCl、Na2CO3三种溶液
B、Na2CO3、Na2SO4、K2S、Na2SO3、BaCl2、NaAlO2六种溶液;
C、CaC2、NaCl、CuSO4、CaCO3、Al2S3五种固体;
A组可选用 (填名称,下同);
B组可选用 ;
C组可选用 。
20.甲、乙两烧杯中分别盛放500mL等物质的量浓度的稀硫酸,向甲烧杯中加入mg铁粉,向乙烧杯加mg锌粒,完全反应后发现有一烧杯中仍有金属剩余,若H2SO4的物质的量浓度为xmol·L-1,则x的范围是
A.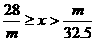 B.
B.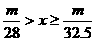
C.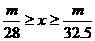 D.
D.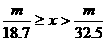
第Ⅱ卷(非选择题,共50分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com