
题目列表(包括答案和解析)
1.石油是一种重要能源,人类正面临着石油短缺、油价上涨的困惑。以下解决能源问题的方法不当的是
A.用木材作燃料 B.用液氢替代汽油 C.开发风能 D.开发地热
23.(8分)
燃烧1.00t含硫质量分数为48.0%的黄铁矿矿石,若在生产过程中,黄铁矿的利用率为90.0%,硫酸的产率为85.0%,且还有质量分数为1.50%的硫留在炉渣里。试计算能够生产多少吨H2SO4质量分数为98.0%的硫酸。
22.(14分)
为测定碳酸钙纯度(设含杂质SiO2),学生设计了如下几个实验方案,请回答每个方案中的问题。
[方案I](1)称取碳酸钙样品 M g;
(2)加入过量盐酸;
(3)收集并测定生成的气体体积 V mL。
问题:如果称量样品时,砝码底部有一处未被实验者发现的残缺,那么测定的碳酸钙的纯度会 (偏高、偏低、无影响)
[方案II](1)称取碳酸钙样品 M g;
(2)用c mol/L 盐酸 V mL(过量)溶解样品;
(3)取溶解后的溶液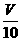 mL,用C′mol/L NaOH溶液滴定,恰好用去V′mL。
mL,用C′mol/L NaOH溶液滴定,恰好用去V′mL。
问题1:列出本实验中所用到的仪器名称(除铁架台及附件、烧杯之外)
。
问题2:加盐酸后是否需要滤出SiO2后再用NaOH滴定 (填选项编号)。
A.需要 B.不需要 C.均可
问题3:碳酸钙纯度计算公式 。
[方案III](1)称取碳酸钙样品 M g;
(2)高温(1000℃)煅烧直至质量不再发生变化,冷却后称量,质量为M′g。
问题1:为什么要煅烧至1000℃且“直至质量不再改变”?
;
问题2:本方案中的“冷却”应如何操作
。
[方案IV](1)称取碳酸钙样品 M g;
(2)加入足量Cmol/L盐酸V mL使之完全溶解;
(3)过滤并取滤液;
(4)在滤液中加入过量C′mol/L Na2CO3溶液V′mL;
(5)将步骤(4)中的沉淀滤出、洗涤、干燥、称重为M′g。
问题1:此方案中不需要的数据是 (填选项编号)。
A.C、V B.C′、 V′ C. M′ D. M
问题2:为减少实验误差,必要的操作是 (填选项编号)。
A.精确测定Na2CO3溶液体积V′ mL
B.精确配制浓度C′mol/LNa2CO3溶液
C.将步骤(3)所得沉淀洗涤,洗涤也应并入(4)中
D.将步骤(3)所得沉淀洗涤、干燥、称量其质量M′g备用
问题3:步骤(5)中要将沉淀进行洗涤,如果未经洗涤,则测定的碳酸钠纯度将
(偏高、偏低、无影响)。
综上所述,你认为4个方案中,最好的方案是 ,其它方案的缺点分别是:
。
方案IV:沉淀的洗涤、干燥、称量操作过程复杂,容易造成较大误差;
方案 ; 。
方案 ; 。
21.(10分)
(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知在101kPa时,32.0gN2H4在氧气中完全燃烧生成氮气,放出热量624kJ(25℃时),N2H4完全燃烧反应的热化学方程式是 。
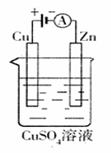 (2)右图是一个电化学过程示意图。
(2)右图是一个电化学过程示意图。
①锌片上发生的电极反应是
②假设使用肼-空气燃料电池作为本过程中的电源,铜片的质量变化128g,则肼一空气燃料电池理论上消耗标标准状况下的空气
L(假设空气中氧气体积含量为20%)
(3)传统制备肼的方法,是以NaClO氧化NH3,制得肼的稀溶液。该反应的离子方程式是 。
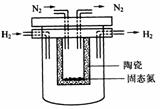 (4)1998年希腊亚里斯多德大学的Marnellos和Stoukides采用高质子导电性的SCY陶瓷(能传递H+),实现了高温常压下高转化率的电化学合成氨。其实验装置如图。阴极的电极反应式为
。
(4)1998年希腊亚里斯多德大学的Marnellos和Stoukides采用高质子导电性的SCY陶瓷(能传递H+),实现了高温常压下高转化率的电化学合成氨。其实验装置如图。阴极的电极反应式为
。
20.(12分)
A、B、C、D、E、F、G是由短周期元素组成的七种物质,其中B、C、F是单质;常温下B、C、E为气体;A物质的焰色反应呈黄色。(下图中反应②的部分产物未表示出来。)
 |
|
各物质间的转化关系 |
根据上图所示转化关系回答:
(1)经测定G属于离子化合物,其电子式为___________。
(2)写反应②的电极反应式:
阳极___________ ; 阴极___ 。
(3)反应③的化学方程式为 ___________ 。
(4)这七种物质中含有共价键的有___________ (用化学式回答)。
19.(6分)
接触法制硫酸的某阶段的反应为:2SO2 +
O2 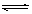 2SO3 ;△H= -196.6kJ/mol。
2SO3 ;△H= -196.6kJ/mol。
(1)该反应在___________(填一种设备)中进行,这种设备中部的装置叫_________,其作用是_______________________________________。
(2)在实际生产中,为实现较快的反应速率及较大的转化率,采用的条件是______________ 。
(3)在上述条件下,将1molSO2和0.5molO2充入某密闭容器中,放出的热量________(填“大于”、“小于”或“等于”)98.3kJ。
18.(7分)
在隔膜法电解食盐水过程中,与电源正极相联的电极上所发生反应为__________ ,与电源负极相连的电极附近溶液的pH__________(填“升高”、“下降”或“不变”)。离子交换膜的作用是 ,若采用无隔膜电解冷的食盐水时,Cl2与 NaOH充分接触,产物仅是NaClO和H2,相应的化学方程式为___________________ 。
17.(5分)
(1)在进行性质实验方案的设计时,要充分了解物质的_________、_________、_________和____ 之间的相互关系。要根据物质的___________,设计实验方案来探索和验证物质所具有的一些性质。
(2)下列实验中所选用的仪器或操作以及结论不合理的是________
A.用托盘天平称量重11.7g氯化钠晶体
B.用碱式滴定管量取25.00mL溴水
C.不宜用瓷坩埚灼烧氢氧化钠、碳酸钠
D.测定溶液的pH时,用洁净、干燥的玻璃棒蘸取溶液,滴在用蒸馏水润湿过的pH试纸上,再与标准比色卡比较
E.仅用蒸馏水和pH试纸作试剂,就可鉴别pH相等的H2SO4和CH3COOH溶液
16.SO42-和 S2O82-结构中,硫原子均位于由氧原子组成的四面体的中心,且所有原子的最外层电子均满足8电子结构。下列说法正确的是

A.SO42-的电子式为 B.S2O82-中没有非极性键
C.S2O82-比SO42- 稳定 D.S2O82-有强氧化性
第II卷(非选择题,共62分)
15. FeS2在空气中充分燃烧的化学方程式为4FeS2 +
11O2 2Fe2O3
+ 8SO2,若agFeS2在空气中充分燃烧,并转移N个电子,则阿伏加德罗常数(NA)可表示为
FeS2在空气中充分燃烧的化学方程式为4FeS2 +
11O2 2Fe2O3
+ 8SO2,若agFeS2在空气中充分燃烧,并转移N个电子,则阿伏加德罗常数(NA)可表示为
A.120N/a B.120a/11N C.11a/120N D.120N/11a
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com