
题目列表(包括答案和解析)
13.在一含Na+的澄清溶液中,可能还存在NH4+、Fe2+、I-、Br-、CO32-、SO32-六种离子中的几种。
①在原溶液中滴加足量的饱和氯水后,有气泡生成,溶液呈黄色;
②向呈橙黄色的溶液中加入BaCl2溶液时无沉淀生成;
③橙黄色溶液不能使淀粉溶液变蓝色。根据上述实验事实推断,
下列说法不正确的是
A.溶液中一定存在Br-、CO32- B.溶液中可能存在NH4+
C.溶液中一定不存在Fe2+、I-、SO32- D.溶液一定呈碱性
12.A、B、C、D为原子序数依次增大的同周期的短周期元素。已知A、C、D三种原子的最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水。下列判断正确的是
A.A、C、D三种元素的最高价氧化物对应的水化物有两种是强碱、一种是强酸,或两种是强酸、一种是强碱
B.A、C、D三种元素有两种是金属、一种是非金属
C.D元素在第三周期第ⅥA族
D.A、B、C三种元素的单质熔、沸点依次降低
11.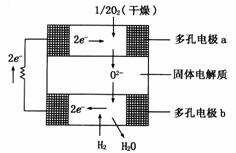 固体氧化物燃料电池是以固体氧化锆-氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过,该电池的工作原理如图所示,其中多孔电极a、b均不参与电极反应。下列判断正确的是
固体氧化物燃料电池是以固体氧化锆-氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过,该电池的工作原理如图所示,其中多孔电极a、b均不参与电极反应。下列判断正确的是
A.有O2参加反应的a极为电池的负极
B.b极的电极反应为:H2 - 2e- + O2- = H2O
C.a极的电极反应为:O2 + 2H2O + 4e- = 4OH-
D.电池的总反应式为:2H2 +
O2  2H2O
2H2O
10.铊(Tl)是某超导材料的组成元素之一,与铝同族,位于第6周期。已知Tl3+在酸性介质中可与Ag发生反应生成Tl+。据此,从理论上看,下列推断不正确的是
A.Tl3+ + 2Ag = Tl+ + 2Ag+ B.Tl3+ + Cu = Tl+ + Cu2+
C.2Tl3+ + 3Zn = 2Tl + 3Zn2+ D.3Tl3+ + 2Al = 3Tl+ + 2Al3+
9.设NA表示阿伏加德罗常数的值,下列叙述中正确的是
A.1 L pH = 1的溶液中含有NA个H+离子
B.100 g 碳酸钙和碳酸氢钾的混合物中含有氧原子数目为3 NA
C.1 mol CH4与1 mol SiO2中所含的共价键数目均为4 NA
D.3.08 g 2CaSO4•H2O晶体中含有结晶水分子数目为0.02NA
8.向某二价金属M的M(OH)2的溶液中加入过量的NaHCO3溶液,生成了MCO3沉淀,过滤,将沉淀置于足量的稀盐酸中,充分反应后,在标准状况下收集到V L气体。如要计算金属M的相对原子质量,你认为还必需提供下列哪项数据
A.M(OH)2溶液的物质的量浓度 B.与MCO3反应的盐酸的物质的量浓度
C.MCO3的质量 D.题给条件充足,不需要在补充数据
7.将SO2气体通入BaCl2溶液至饱和,未见沉淀生成,继续通入另一种气体,仍无沉淀,则通入的气体可能是
A.CO2 B.NH3 C.NO2 D.H2S
6.长征二号捆绑式火箭推进剂以肼(N2H4)作为燃料,NO2作为氧化剂,反应生成N2和水蒸气。已知:
N2(g) + 2O2(g) = 2NO2(g);△H=+67.7 kJ/mol
N2H4(g) + O2(g) = N2(g) + 2H2O(g);△H=-534 kJ/mol
下列关于肼和NO2反应的热化学方程式中,正确的是
A.2N2H4(g) + 2NO2(g) = 3N2(g) + 4H2O(l);△H=-1135.7 kJ/mol
B.2N2H4(g) + 2NO2(g) = 3N2(g) + 4H2O(g);△H=-1000.3 kJ/mol
C.N2H4(g) + NO2(g) = 3/2N2(g) + 2H2O(l);△H=-1135.7 kJ/mol
D.2N2H4(g) + 2NO2(g) = 3N2(g) + 4H2O(g);△H=-1135.7 kJ/mol
5.下列混合物的分离或提纯操作中不正确的是
A.除去N2中的少量O2,可通过灼热的Cu网后,收集气体
B.除去Fe(OH)3胶体中混有的Cl-离子,可用渗析的方法
C.除去乙醇中的少量NaCl,可用蒸馏的方法
D.重结晶、滴定操作都可用于提纯物质
4.下列实验操作与安全事故处理正确的是
A.金属钠着火时可用干粉灭火器扑灭
B.在硫酸铜晶体结晶水含量测定的实验中,称量操作至少需要四次
C.铜与浓硫酸反应时,用蘸有浓溴水的棉花放在导管口吸收多余的气体
D.在250 mL烧杯中加入216 mL水和24 g NaOH固体,配制10%NaOH溶液
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com