
题目列表(包括答案和解析)
1.鉴别纯碱、石灰石、芒硝和石膏四种固体,应选用 ( )
A.烧碱溶液 B.水和盐酸 C.硝酸 D.氯化钡和硝酸混合液
26.(10分) 晶体是质点(分子、离子或原子等)在空间有规则地排列、具有整齐外形、以多面体出现的固体物质。在空间里无限地周期性的重复能形成晶体的、具有代表性的最小单元,称为晶胞。一种Al-Fe合金的立体晶胞如下图所示。

请据此回答下列问题:
(1) 确定该合金的化学式____________。
(2) 若晶体的密度=ρ g/cm3,则此合金中最近的两个Fe原子之间的距离(用含ρ的代数式表示,不必化简)为___________________cm。
(3) 取2.78 g的该合金粉末溶于100 mL某稀硝酸溶液中,待反应完全后得到1.12 L NO气体(标准状况,设两者恰好完全反应),则原硝酸溶液的物质的量浓度为______mol/L,反应后溶液中Fe3+离子的物质的量浓度为______mol/L。
徐州市2005-2006学年度高三第一次质量检测
25.(8分) 在室温下,向200 mL Cu(IO3)2饱和溶液(密度为1.0 g/cm3)中加入足量的经酸化的KI溶液,发生如下的反应:
5I- + IO3- + 6H+ = 3I2 + 3H2O
2Cu2+ + 4I- = 2CuI + I2
反应后,用0.22 mol/L Na2S2O3溶液滴定(I2 + 2S2O32- = 2I- + S4O62-),消耗了35.30 mL Na2S2O3溶液。计算原饱和溶液中Cu(IO3)2的物质的量浓度以及质量分数分别是多少?
24.(10 分) 已知下图每一方框中的字母代表一种反应物或生成物(图中部分反应物或生成物没有列出)。其中,化合物石灰氮是由Ca、N、C等三种元素组成的盐,它以前是一种常用的肥料,其含钙、碳的质量分数分别为50%、15%。反应①是石灰氮的完全水解,其产物之一可方便地制成一种氮肥。通常状况下,C为气体。
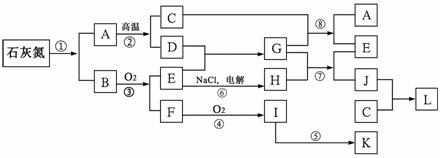
请按要求回答:
(1) 写出石化氮的化学式 ;
(2) 写出反应①的化学方程式:
;
(3) 除反应②、③、④、⑤是应用于工业生产外,还有两个反应是运用于工业生产的反应,是 和 (填序号),它们反应的化学方程式分别是 和 。
23.(9 分) 工业上制备氯化铜时,是将浓盐酸用水蒸汽加热至80℃左右,慢慢加入粗制氧化铜粉(含杂质氧化亚铁),充分搅拌,使之溶解,反应如下:
CuO + 2HCl = CuCl2 + H2O ,FeO + 2HCl = FeCl2 + H2O。
已知:pH≥9.6时,Fe2+以Fe(OH)2的形式完全沉淀;
pH≥4.4时,Cu2+以Cu(OH)2的形式开始沉淀; pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀;
pH在3-4时,Fe3+以Fe(OH)3的形式完全沉淀。
(1) 为除去溶液中Fe2+,可采用的方法是 。
(2) 工业上为除去溶液中的Fe2+,常使用NaClO,当向溶液中加入NaClO后,溶液的pH变化是 。
(3) 若此溶液只含Fe3+时,要调整pH在3-4之间,此时最好向溶液中加入 。
(4) 已知溶液中c(Cu2+)与溶液pH的关系为lg c(Cu2+)=8.6-2pH,若溶液中c(Cu2+)为1 mol/L,要保证此溶液中Cu2+刚好不发生Cu(OH)2沉淀,则溶液pH应为___________,此时溶液中的铁离子能否沉淀完全_________(填“能”或“否”)。
22.(8分) 甲、乙、丙、丁是4种短周期元素,它们的原子序数依次增大,其中甲、丙及乙、丁分别是同主族元素,又知乙、丁两元素的原子核中质子数之和是甲、丙两元素原子中质子数之和的2倍,甲元素的一种同位素核内无中子。
(1) 写出元素符号:丙:_________,丁:_________。
(2) 写出甲、乙两种元素形成的含有非极性键的极性分子的电子式________________。
(3) 写出2种均含甲、乙、丙、丁四种元素的化合物相互反应逸出气体的化学方程式:
。
21.(11分) 我国化学家侯德榜,改革国外的纯碱生产工业生产工艺,可简要表示如下:

(1)为了有效除去精盐中含有的少量Ca2+、Mg2+、SO42-等杂质,加入试剂的合理顺序为______(填字母)。
a. 先加NaOH,后加Na2CO3,再加BaCl2
b. 先加NaOH,后加BaCl2,再加Na2CO3
c. 先加BaCl2,后加NaOH,再加Na2CO3
(2) 为检验Na2CO3产品中是否含有氯化钠,可取少量试样溶于水后,再滴加_________;此实验中所需的仪器有____________________________。
(3) 所得纯碱中含有NaCl杂质,若起始时取试样a g、U型管(装有碱石化)的质量为b g,请你利用下列装置完成纯碱试样中Na2CO3的质量分数的测定。
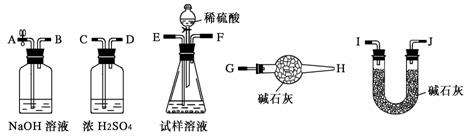
① 实验时,装置的连接顺序从左到右依次为(填各装置导管口的编号):A____________
② 在反应前要从A处缓缓鼓入一定量空气后再连接U型管等仪器的目的是________; 在反应后若不从A处缓缓鼓入一定量空气将导致测试结果_________(填“偏大” 、“偏小”或“不变”)。
③ 若反应完全后最终U型管的质量为c g,则试样中纯碱的质量分数的计算式为_________________________________。
20.(11分) (1) 请填写下表中空白,完成检验明矾中的阴离子和阳离子的实验设计。
|
操作 |
现象 |
结论或离子方程式 |
|
①
取少量明矾放入烧杯中,加适量蒸馏水,并搅拌,配成稀溶液;在三支试管中分别加入约0.5 mL稀明矾溶液。 |
|
|
|
②
在第一支试管中滴加NaOH溶液至过量。 |
溶液中的现象是_____ _ _______________________ |
反应的离子方程式: ______________________ |
|
③ 在第二支试管中滴加_______。 |
溶液中有白色沉淀产生 |
Ba2+
+ SO42- = BaSO4↓ |
|
④
对第三支试管溶液用__________ ________________________。 |
_______________________________________ |
证明有K+ |
|
⑤
另取少量明矾晶体,放入一支干燥试管中,用酒精灯加热。 |
在试管内壁和管口有水珠产生 |
证明有结晶水 |
(2) 在常温下,取两片质量相等、外形相同、表面经过砂纸打磨(完全除掉了氧化膜)的铝片,分别加入到体积相同、c(H+)均为3 mol/L的稀硫酸和稀盐酸溶液的两支试管中,发现铝片在稀盐酸中产生氢气的速率明显比在稀硫酸中快。请你对上述现象的原因提出假设并用设计实验方案来验证你的假设。
你的假设是:假设一:_____________________________________________________;
假设二:_____________________________________________________。
你的实验方案是(说明实验步骤、现象和结论):
。
19.(9分)(1) 下列有关实验操作或判断不正确的是 _________(填有关序号,多选扣分)。
A.用10 mL量筒准确量取稀硫酸溶液 8.0 mL
B.用干燥的pH试纸测定氯水的pH
C.用碱式滴定管量取KMnO4溶液 19.60 mL
D.使用容量瓶配制溶液时,俯视液面定容后所得溶液的浓度偏大
E. 将饱和FeCl3溶液滴入蒸馏水中即得Fe(OH)3 胶体
F.圆底烧瓶、锥形瓶、蒸发皿加热时都应垫在石棉网上
(2) 用50 mL 0.5 mol/L 的盐酸与50 mL 0.55 mol/L的NaOH溶液进行中和热的测定
请回答下列问题:
① 在实验中使用的仪器除大烧杯、小烧杯、环形玻璃搅拌棒、泡沫塑料或纸条、泡沫塑料板或硬纸板(中心有两个小孔)外,还必须要用到的仪器有____________________。
② 要想提高中和热实验的准确性,可采用的措施除以列出的三种以外,请你再写出三种:
a. 如果按教材中的方法做,一定要是小烧杯杯口与大烧杯杯口相平。
b. 盐酸和NaOH溶液浓度的配制要准确,且NaOH溶液的浓度须稍大于盐酸的浓度。
c. 实验操作时动作要快,注意不要将溶液洒到外面。
d. ____________________________________________________________________。
e. ____________________________________________________________________。
f. ____________________________________________________________________。
18.化合物A、B、C、D各由两种元素组成,甲、乙、丙是三种单质。这些常见的化合物与单质之间存在如下关系(已知化合物C是一种有机物),
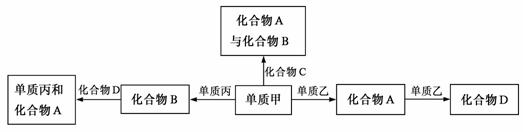
以下结论不正确的是
A.上图所示的五个转化关系中,有三个是化合反应
B.上述转化关系所涉及的化合物中有一种是电解质
C.甲、乙、丙三种单质的晶体均是分子晶体
D.上图所示的五个转化关系中,均为放热反应
第二卷 (非选择题 共76分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com