
题目列表(包括答案和解析)
17.(6分)
(1)这四种元素是X ,Y ,Z ,W
(2)这四种元素原子半径的大小为 > > >
(3)W、X元素的最高价氧化物对应的水化物的碱性强弱为 <
25.(6分)为了预防碘缺乏病,国家规定每千克食盐中应含有40-50毫克的碘酸钾。为检验某种食盐是否为加碘的合格食盐,某同学取食盐样品428克,设法溶解出其中全部的碘酸钾。 将溶液酸化并加入足量的碘化钾淀粉溶液,溶液呈蓝色,再用0.030mol/L的Na2S2O3溶液滴定,用去18.00mL时蓝色刚好褪去。试通过计算说明该加碘食盐是否为合格产品。
有关反应如下:IO3-+5I-+6 H+=3I2+3H2O;
I2+2S2O32-=2I-+S4O62-
 杭州第十中学2005学年高三月考(10月)
杭州第十中学2005学年高三月考(10月)
化学答卷 成绩
24. (4分)右图为某市售盐酸试剂瓶标签上的部分数据。
(4分)右图为某市售盐酸试剂瓶标签上的部分数据。
问:该盐酸的物质的量浓度为多少?(列式计算)
23.(6分)在氯酸钾的分解反应里,二氧化锰的催化问题到目前还没有肯定的解释。鉴于制得的氧气中有氯气的气味,生成的氯化钾又略显紫红色,认为反应过程如下:
Ⅰ:2KClO3+2MnO2==2A+B↑+C↑
Ⅱ:2A==D+MnO2+C↑
Ⅲ:B+D==2KCl+MnO2+O2↑
①反应Ⅰ 氧化产物为(填化学式) ▲ 。
②反应Ⅲ的化学方程式为 ▲ 。
③按照上述反应过程,若生成1.5molO2,总共有 ▲ mol电子发生转移。
22.(10分)麻醉剂的发现和使用,是人类历史上了不起的一项成就,它可使患者在接受治疗时感觉不到疼痛。
(1)“笑气”(N2O)是人类最早应用于医疗的麻醉剂之一。有关理论认为N2O与CO2具有相似的结构(包括电子式);已知N2O分子中氧原子只与一个氮原子相连,则N2O的电子式可表示为___▲___,其空间构型是__▲___型,由此可见它是___▲__分子(填“极性”或“非极性”)。
(2)另一种常用麻醉剂氯仿,常因保存不慎而被氧化,产生剧毒物光气(COCl2):2CHCl3+O2 →2HCl+2COCl2,为防止中毒事故,使用前可用于检验氯仿是否变质的试剂是 ▲ 。
A、酚酞试液 B、淀粉碘化钾溶液
C、NaOH溶液 D、硝酸银稀溶液
(3)作为麻醉剂,氙气在医学上备受重视,氙能溶于细胞质的油脂里,引起细胞的麻醉和膨胀,从而使神经末梢作用暂时停止,人们曾使用体积分数为80%的氙气和20%的氧气组成混合气体,作为无副作用的麻醉剂。
①氙在元素周期表中位于第 ▲ 周期, ▲ 族,它的原子序数为 ▲ 。
②稀有气体氙的化学性质不活泼,但它在一定条件下可与其他物质反应生成化合物。现取1 mol氙气和3.5 mol氟气放于密闭容器中,在一定条件下使反应完毕,剩余1.5 mol氟气,同时有1 mol白色固体生成,此白色固体的化学式为 ▲ 。
21.(6分)下列有关实验的叙述,正确的是(填序号) ▲
(A)配制500 mL某物质的量浓度的溶液,可用两只250 mL的容量瓶
(B)用渗析法分离淀粉中混有的NaCl杂质
(C)无法用分液漏斗将甘油和水的混合液体分离
(D)用酸式滴定管量取20.00mL高锰酸钾溶液
(E)为了测定某溶液的pH,将未经湿润的pH试纸浸入到待测溶液,过一会取出,与标准比色卡进行对比
(F)用浓氨水洗涤做过银镜反应的试管
(G)配制银氨溶液时,将稀氨水慢慢滴加到硝酸银溶液中,产生沉淀后继续滴加到沉淀刚好溶解为止
(H)浓硫酸不小心沾到皮肤上,立刻用稀NaOH溶液洗涤
(J)在氢氧化铁胶体中加入少量硫酸会产生沉淀
(K)用结晶法可以除去硝酸钾中混有的少量氯化钠
20.(8分)根据实验室中测定硫酸铜晶体结晶水含量的实验,填写下列空白:
(1)从下列仪器中选出所需仪器(用标号字母填写)____ ▲_____。
A.托盘天平(带砝码) B.研钵 C.试管夹 D.酒精灯 E.蒸发皿 F.玻璃棒 G.坩埚 H.干燥器 I.石棉网 J.三脚架
除上述仪器外,还需要的仪器是__▲____。
(2)某学生实验后得到以下数据
|
加热前质量 |
加热后质量 |
|
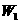 (容器) (容器) |
 (容器+晶体) (容器+晶体) |
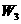 (容器+无水硫酸铜) (容器+无水硫酸铜) |
|
5.4g |
7.9g |
6.8g |
该学生测定结果是偏高还是偏低?____ ▲_____,从下列分析中进行选择,该学生实验误差的原因可能是(填写字母)___ ▲_____。
A.加热前称量时容器未完全干燥 B.最后两次加热后的质量相差较大(大于0.1g)
C.加热后容器未放入干燥器中冷却 D.加热过程中有少量晶体溅失
19.(8分)某无色溶液中含有K+、Cl-、OH-、SO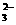 、SO
、SO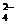 ,为检验溶液中所含的各阴离子,限用的试剂有:盐酸、硝酸、硝酸银溶液、硝酸钡溶液、品红溶液和酚酞试液。检验其中OH-的实验方法从略,检验其他阴离子的过程如下图所示。
,为检验溶液中所含的各阴离子,限用的试剂有:盐酸、硝酸、硝酸银溶液、硝酸钡溶液、品红溶液和酚酞试液。检验其中OH-的实验方法从略,检验其他阴离子的过程如下图所示。
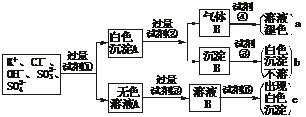
(1)图中试剂①-⑤溶质的化学式分别是:
①___▲___,②___▲___,③__▲____,④___▲___,⑤___▲__。
(2)图中现象a、b、c表明检验出的离子分别是:a__▲____、b__▲____、c___▲___。
18.(6分)某主族元素R的单质可被稀硝酸氧化为R3+,R3+最外层有两个电子,在碱性条件下,R3+可被Cl2氧化成带一个单位负电荷的含氧酸根阴离子,该阴离子在酸性条件下能将Mn2+氧化成MnO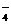 ,同时本身又被还原为R3+。试写出有关反应的离子方程式(不必确定R为何元素):
,同时本身又被还原为R3+。试写出有关反应的离子方程式(不必确定R为何元素):
(1)__ ▲_____;
(2) __ ▲_____;
(3) __ ▲_____。
17.(6分)W、X、Y、Z四种短周期元素的原子序数为X>W>Z>Y,W原子的最外层电子数是X原子最外层电子数的一半,Y原子最外层电子数是次外层电子数的2倍,Z原子次外层电子数是最外层电子数的1/3,这四种元素原子核电荷数总和为37。
(1)这四种元素是X ▲ ,Y ▲ ,Z ▲ ,W ▲ (填元素符号)
(2)这四种元素原子半径的大小为 ▲ > ▲ > ▲ > ▲ (填元素符号)
(3)W、X元素的最高价氧化物对应的水化物的碱性强弱为 ▲ < ▲ (用化学式表示)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com