
题目列表(包括答案和解析)
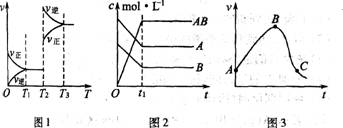
此类图象能说明各平衡体系组分(或某一成分)在反应过程中的变化情况。如A+B 2AB反应情况如图2,此类图象要注意各物质曲线的折点(达平衡)时刻相同,各物质浓度变化的内在联系及比例符合化学方程式中的系数关系。
2AB反应情况如图2,此类图象要注意各物质曲线的折点(达平衡)时刻相同,各物质浓度变化的内在联系及比例符合化学方程式中的系数关系。
 例2.(2001全国高考)在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如下图,下列表述中正确的是( )
例2.(2001全国高考)在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如下图,下列表述中正确的是( )
A.反应的化学方程式为:2 M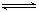 N
N
B.t2时,正逆反应速率相等,达到平衡
C.t3时,正反应速率大于逆反应速率
D、t1时,N的浓度是M浓度的2倍
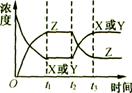
 练习2.今有反应X(g)+Y(g) 2Z(g)(正反应为放热反应),若反应开始经t1s后达到平衡,又经t2 s后,由于反应条件的改变使平衡破坏,到t3
s时又达到平衡,如图所示,试分析从t2到t3的曲线变化的原因是
练习2.今有反应X(g)+Y(g) 2Z(g)(正反应为放热反应),若反应开始经t1s后达到平衡,又经t2 s后,由于反应条件的改变使平衡破坏,到t3
s时又达到平衡,如图所示,试分析从t2到t3的曲线变化的原因是
A增大了X和Y的浓度 B.使用了催化剂
C.增加了反应体积的压强 D、升高了反应的温度
此类图象定性揭示了V正、V逆随时间(含条件改变对速率的影响)而变化的规律,体现了平衡的“动、等、定、变”的基本特征,以及平衡移动的方向等。如N2+3H2
 2NH3;△H<0建立平衡后加热对速率的影响如图1。
2NH3;△H<0建立平衡后加热对速率的影响如图1。
例题1.可逆反应aX(g)+b Y(g)  cZ(g)在一定温度下的一密闭容器内达到平衡后,t0时改变某一外界条件,化学反应速率(v)一时间(t)图象如图。则下列说法中正确的是( )
cZ(g)在一定温度下的一密闭容器内达到平衡后,t0时改变某一外界条件,化学反应速率(v)一时间(t)图象如图。则下列说法中正确的是( )
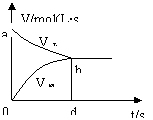
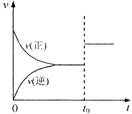 A.若a+b=c,则t0时只能是增大了容器的压强
A.若a+b=c,则t0时只能是增大了容器的压强
B.若a+b=c,则t0时只能是加入了催化剂
C.若a+b≠c,则t0时只能是增大了容器的压强
D、若a+b≠c,则t0时只能是加入了催化剂
练习1.在容积固定的2L密闭容器中,充入X、Y各2mol,发生可逆反应X(g)+2Y(g)
 2Z(g),并达到平衡,以Y的浓度改变表示的反应速率v正、v逆与时间t的关系如图。则Y的平衡浓度表达式正确的是(式中S指对应区域的面积)…………( )
2Z(g),并达到平衡,以Y的浓度改变表示的反应速率v正、v逆与时间t的关系如图。则Y的平衡浓度表达式正确的是(式中S指对应区域的面积)…………( )
A.2-S aob B、1-Saob C.2-Sabdo D.1-Sbod
29. (8分)下图每一方框中的字母代表一种反应物或生成物,它们都是中学化学中常见的物质。产物J是含A金属元素的胶状白色沉淀,I为NaCl溶液,L是水,D是淡黄色固体。
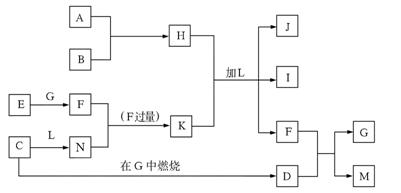
试填写下列空白:
⑴F的化学式为___ CO__ 。
⑵检验M中阴离子常用的试剂是盐酸和澄清石灰水 。
⑶反应C+G→D的化学方程式是___2Na+O_ 。
⑷写出反应H+L+K→J+I+F的离子方程式:Al3++3HCO-==Al(OH)↓+3CO↑ 。
28.(9分)石灰氮(固体甲)是一种古老而多用途的有效肥料,它很容易用廉价的普通化学品乙来生产,乙高温加热分解产生白色固体A和无色气体B,后者不支持燃烧。用碳高温还原A生成灰色固体C和气体D,C和D能进一步氧化,且C必须密封保存,否则遇潮湿空气即产生含碳质量分数最高的常见气态烃,C与氮气反应,最终生成固体甲。经测定固体甲由三种元素组成,其中钙元素占50.00%、碳占15.00%(元素质量分数)
⑴完成下列合成固体甲的反应方程式:[由“石灰氮是化肥”可知固体甲中含钙、氮元素,含碳量最高的气态烃必是C2H2,可知C是CaC2,甲中含氮元素质量分数35.00%,故甲是CaCN2。(以上推理过程不作要求)]
① 乙 A+B:CaCaO+C
A+B:CaCaO+C
② A+碳→C+D:CaO+3C==CaC+CO↑
③ C+氮气→甲+单质:CaC+NCaCN+C
⑵写出固体甲水解的反应方程式:CaCN+3HOCaCO↓+2NH↑ 。
27. (19分)A、B、C、D为4种常见的短周期元素,常温下A、B可形成两种液态化合物,其最简式分别为BA和B2A;B与D可形成分子X,也可形成阳离子Y,X、Y在水溶液中酸、碱性正好相反;C+的焰色反应呈黄色。
⑴C元素在周期表中的位置是: 第三周期, 第一主族 ;液态X类似B2A,也能微弱电离产生电子数相同的两种离子,则液态X的电离方程式为:2NHNH+ + N H2-。
⑵M、N是由A、B、C、D四种元素中任意三种组成的不同类型的强电解质,M的水溶液呈碱性,N的水溶液呈酸性,且物质的量浓度相等的M、N溶液中水的电离程度前者小于后者。则M、N分别为(填化学式) NaOH 、 NHNO 3;若将0.1mol·L-1 M和0.2mol·L-1 N两种溶液等体积混合后所得溶液中离子浓度的大小顺序为: _ c(NO-) > c(NH+) > c(Na+) > c(OH-) > c(H+) 。
⑶氮可以形成多种离子,如N3-、N3-、NH2-、NH4+、N2H5+、N2H62+。N2H6+是由中性分子结合质子形成的,有类似于NH4+的性质。
① N3-离子半径比Na+离子半径__大____(填“大”、“小”),写出Na3N与水反应的化学方程式: NaN + 3HO = 3NaOH + NH↑ 。
② NH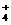 离子中N-H键的键角为 109°28’,离子化合物NH5的电子式为: 。
离子中N-H键的键角为 109°28’,离子化合物NH5的电子式为: 。
③ 写出N2H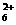 离子与过量强碱溶液反应的离子方程式:NH2+ + 2OH- = NH + 2HO 。
离子与过量强碱溶液反应的离子方程式:NH2+ + 2OH- = NH + 2HO 。
26. S2Cl2是一种金黄色易挥发的液体(熔点:-76℃,沸点:138℃),具有强烈的窒息性,且易与水发生水解反应,生成H2S、SO2、H2SO3、H2SO4等物质。人们使用它作橡胶硫化剂,使橡胶硫化,改变生橡胶热发粘冷变硬的不良性能。
在熔融的硫中通以氯气即可生成S2Cl2。下图是实验室用S和Cl2制备S2Cl2的装置(夹持装置、加热装置均已略去)。

(1) 已知S2Cl2分子结构与H2O2相似,请写出S2Cl2的电子式: 。
(2) 装置a中应放试剂为: 浓HSO ,其作用为: 干燥 Cl ;装置c为何水平放置: 防止熔融的硫堵塞导管 ;装置d的名称是: 冷凝管 ,它的作用是:使生成的S冷凝成液体 。
(3) 该实验的操作顺序应为: ②③①⑤④(或③②①⑤④) (用序号表示)。
①加热装置c ②通入Cl2 ③通冷凝水 ④停止通Cl2 ⑤停止加热装置c
(4) 图中f装置中应放置的试剂为: 碱石灰 ,其作用为: 吸收Cl尾气,防止空气中的水汽使SCl水解 。
13. 已知在25℃,101kPa下,lgC8H18(辛烷)燃烧生成二氧化碳和液态水时放出48.40kJ
A.热量。表示上述反应的热化学方程式正确的是:
C8H18(1)+12.5O2(g)=8CO2(g)+9H2O(g) △H=-48.40kJ·mol-1
B.C8H18(1)+12.5O2(g)=8CO2(g)+9H2O(1) △H=-5518kJ·mol-1
C.C8H18(1)+12.5O2(g)=8CO2(g)+9H2O(1) △H=+5518kJ·mol-1
D.C8H18(1)+12.5O2(g)=8CO2(g)+9H2O(1) △H=-48.40kJ·mol-1
12.已知某溶液中存在较多的H+、SO42-、NO3-,则该溶液中还可能大量存在的离子组是
A.Al3+、CH3COO-、Cl- B.Mg2+、Ba2+、Br-
C.Mg2+、Cl-、I- D.Na+、NH4+、Cl-
11.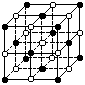 KO2的晶体结构与NaCl相似,可以看作是Na+的位置用K+代替,
KO2的晶体结构与NaCl相似,可以看作是Na+的位置用K+代替,
Cl-的位置用O2-代替,下列对KO2晶体结构的描述正确的是
A.和K+距离相同且最近的O2-共有8个
B.和K+距离相同且最近的K+共有6个
C.和K+距离相同且最近的O2-构成的多面体是正八面体
D.和K+距离相同且最近的O2-构成的多面体是正六面体
10.下列离子方程式中不正确的是
A.向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全:
Ba2++2OH-+2H++SO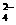 =BaSO4↓+2H2O
=BaSO4↓+2H2O
B.用Pt电极电解MgCl2溶液:Mg+2Cl-+2H2O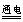 Mg(OH)↓+H2↑+Cl2↑
Mg(OH)↓+H2↑+Cl2↑
C.碳酸氢钠溶液与硫酸氢钠溶液反应:HCO3-+H+=CO2↑+H2O
D.将少量的硝酸银溶液滴入氨水中:Ag++2NH3·H2O=[Ag(NH3)2]++2H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com