
题目列表(包括答案和解析)
7.相等物质的量的X气体和Y气体混合后,一定条件下发生反应:X(g)+Y(g) nZ(g)。保持压强不变,经时间t,Z气体在反应混合物中的体积分数与温度(T)的关系如图Ⅰ所示。
nZ(g)。保持压强不变,经时间t,Z气体在反应混合物中的体积分数与温度(T)的关系如图Ⅰ所示。
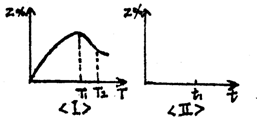 (1) 此反应的正反应方向是(填吸热或放热)
反应。
(1) 此反应的正反应方向是(填吸热或放热)
反应。
(2) T1表示此反应在时间t内达化学平衡时的(填最高或最低) 温度。若保持T1不变(此时间为t1),请在图Ⅱ上描绘出Z%与时间t的关系曲线。
(3) 在T<T1的某一温度时,该反应能否建立平衡(填能或不能) 。
(4) 若在T2时增大压强,达新平衡时Z%将增大,则化学方程式中n的取值为 。
6. 某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:
某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:
(1)该反应的化学方程式为 ;
(2)反应开始至2min,气体Z的平均反应速率为 ;
(3)若X、Y、Z均为气体,反应达平衡时:
①此时体系的压强是开始时的 倍;
②若此时只将容器的体积扩大为原来的2倍,达新平衡时,容器内温度将降低(容器不与外界进行热交换),则该反应为 反应(填“放热”或“吸热”);达新平衡时,容器内混合气体的平均分子量比原平衡时 (填增大、减小或相等);
(4)此反应达平衡后,若只加大体系压强,Z的物质的量减少,若Y是气体,则X的聚集状态是 。
5. 往一体积不变的密闭容器中充入H2和I2,发生反应H2(g)+I2(g)
往一体积不变的密闭容器中充入H2和I2,发生反应H2(g)+I2(g)  2HI(g);△H<0,当达到平衡后,t0时改变反应的某一条件(混合气体物质的量不变),且造成容器内压强增大,下列说法正确的是 ( )
2HI(g);△H<0,当达到平衡后,t0时改变反应的某一条件(混合气体物质的量不变),且造成容器内压强增大,下列说法正确的是 ( )
A、容器内气体颜色变深,平均分子量不变
B.平衡不移动,混合气体密度增大
C.H2转化率增大,HI平衡浓度变小
D、改变条件前后,速度图象为(如右图)
4. mA(s)+nB(g)
mA(s)+nB(g)  pC(g);△H>0的可逆反应中,在恒温条件下,B的体积分数B%与压强(p)关系如图所示。有关叙述正确的是 ( )
pC(g);△H>0的可逆反应中,在恒温条件下,B的体积分数B%与压强(p)关系如图所示。有关叙述正确的是 ( )
A.m+n<p
B.n>p
C、x点,v正> v逆,y点,v正< v逆
D、x点比y点反应速率漫
3.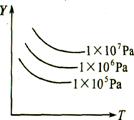 左图表示外界条件(温度、压强)的变化对下列反应的影响:
左图表示外界条件(温度、压强)的变化对下列反应的影响:
L(s)+G(g)  2R(g);△H>0,则图中Y轴是指( )
2R(g);△H>0,则图中Y轴是指( )
A.平衡混合气中R的质量分数
B、平衡混合气中G的质量分数
C.G的转化率
D.L的转化率
2. 现有可逆反应A(g)+B(g
现有可逆反应A(g)+B(g 3C(g),右图中甲、乙、丙分别表示在不同的条件下,生成物c在反应混和物中的百分含量(C%)和反应时间的关系:
3C(g),右图中甲、乙、丙分别表示在不同的条件下,生成物c在反应混和物中的百分含量(C%)和反应时间的关系:
(1)若甲图中两条曲线分别表示有催化剂和无催化剂时的情况,则 曲线是表示有催化剂时的情况。
(2)若乙图中的a曲线表示200℃和b曲线表示100℃时的情况.则此可逆反应的正反应是 热反应(填“放热”或“吸热”),其△H 0(填“大于”、“小于”或“等于”)。
(3)若丙图中两条曲线分别表示不同压强下的情况,则 曲线是表示压强较大的情况。
 如图(右1)在一定条件下,将X、Y按不同的物质的量比放入密闭容器中反应,平衡后测得X和Y的转化率(α)与起始两物质的量之比[n(x)/n(y)]的关系如图,据此可推知X、Y,的反应式系数比为3:1.
如图(右1)在一定条件下,将X、Y按不同的物质的量比放入密闭容器中反应,平衡后测得X和Y的转化率(α)与起始两物质的量之比[n(x)/n(y)]的关系如图,据此可推知X、Y,的反应式系数比为3:1.
 如图(右2)曲线是其他条件不变时,其反应物的最大转化率(α)与温度(T)的关系曲线,图中标出的1、2、3、4四个点,表示v正>
v逆点是3,表示v正<v逆的点是1,而2,4点表示v正= v逆。
如图(右2)曲线是其他条件不变时,其反应物的最大转化率(α)与温度(T)的关系曲线,图中标出的1、2、3、4四个点,表示v正>
v逆点是3,表示v正<v逆的点是1,而2,4点表示v正= v逆。
例4.在容积固定的密闭容器中存在如下反应: A(g)+3B(g)  2C(g); △H<0
2C(g); △H<0
 某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图:
某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图:
下列判断一定错误的是
A、图I研究的是不同催化剂对反应的影响,且乙使用的催化剂效率较高
B、图Ⅱ研究的是压强对反应的影响,且甲的压强较高
C.图Ⅱ研究的是温度对反应的影响,且甲的温度较高
D.图Ⅲ研究的是不同催化剂对反应的影响,且甲使用的催化剂效率较高
练习4.已知某可逆反应mA(g)+nB(g)  pC(g)在密闭容器中进行,下图表示在不同反应时间t时,温度T和压强p与
pC(g)在密闭容器中进行,下图表示在不同反应时间t时,温度T和压强p与 反应物B在混合气体中的体积分数B%的关系曲线,由曲线分析,下列判断正确的是 ( )
反应物B在混合气体中的体积分数B%的关系曲线,由曲线分析,下列判断正确的是 ( )
A. Tl<T2 p1>p2,m+n>p △H<0
B. Tl>T2 p1<p2,m+n>p △H>0
C. Tl<T2 p1>p2,m+n<p △H<0 D、 Tl>T2 p1<p2,m+n<p △H>0
巩固练习
1.在一定条件下,反应A(g)+B(g)  C(g);△H<0达到平衡后,根据下列图象判断;
C(g);△H<0达到平衡后,根据下列图象判断;

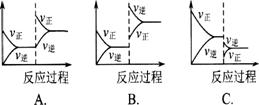
(1)升温,达到新的平衡的是( ) (2)降压.达到新的平衡的是( )
(3)减少c的量,移向新平衡的是( ) (4)增加A的量,移向新平衡的是( )
(5)使用催化剂,达到平衡的是( )
该类图的纵坐标为物质的平衡浓度(c)或反应物的转化率(α),横标为温度(T)或压强(P),常见类型如右图。

 例3.对于反应m
A(s)+nB(g) eC(g)+fD(g),反应过程中,当其他条件不变时,C在混合气体中的体积分数与T(温度)或p(压强)关系如图所示,下面几种叙述中正确的是(
)
例3.对于反应m
A(s)+nB(g) eC(g)+fD(g),反应过程中,当其他条件不变时,C在混合气体中的体积分数与T(温度)或p(压强)关系如图所示,下面几种叙述中正确的是(
)
 A.使用催化剂,平衡时C在混合气体中的体积分数增大
A.使用催化剂,平衡时C在混合气体中的体积分数增大
B.升温,化学平衡向正反应方向移动
C、化学方程式的化学计量数关系n<e+f
 D.其他条件不变,增加体系的压强,平衡正向移动
D.其他条件不变,增加体系的压强,平衡正向移动
练习3.T℃时,A气体与B气体反应生成C气体.反应过程中A、B、C浓度变化如图(Ⅰ)所示;若保持其他条件不变,温度分别为T1和T2时,B的体积百分含量与时间的关系如图(Ⅱ)所示.则下列结论正确的是( )
A.在(t1+10)min时,保持其它条件不变,增大压强,平衡向逆反应方向移动
B.其它条件不变,升高温度,正、逆反应速率均增大,且A的转化率增大
C、T℃时,若由0.4mol/L A、0.4mol/L B和0.2mol/L C反应,达到平衡后,C的浓度仍为0.4mol/L
D. (t1+10)min时,保持压强不变,通入稀有气体,平衡向正反应方向移动
 常见形式有如下几种,如图。(C%指产物百分数;B%指某反应物百分数)(在其他条件不变时,改变任一条件,如使用催化剂或温度升高或压强增大,都能缩短到达平衡的时间)
常见形式有如下几种,如图。(C%指产物百分数;B%指某反应物百分数)(在其他条件不变时,改变任一条件,如使用催化剂或温度升高或压强增大,都能缩短到达平衡的时间)

如Zn与足量盐酸的反应,反应速率随时间的变化如图3。解释原因:AB段(v渐增),因反应为放热反应,随反应的进行,温度渐增,导致反应速率的渐增;BC段(v渐小),则主要因为随反应的进行。溶液中c(H+)渐小,导致反应速率的减小。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com