
题目列表(包括答案和解析)
7、在热的稀硫酸溶液中溶解了11.4g FeSO4,当加入25mL 1.0mol/L KNO3溶液后,溶液中Fe2+ 恰好全部转化成Fe3+,KNO3也反应完全,并有氮氧化物气体逸出。则逸出的氮氧化物是( )
A、N2O B、N2O3 C、 NO D、NO2
6、下列各组物质中仅用水就可以鉴别的是( )
①固体:NaCl、NaOH、NH4NO3;②气体:H2、O2、SO2;③液体:苯、酒精、四氯化碳;④固体:Ba(NO3)2、KCl、Na2SO4;⑤固体:AlCl3、Na2CO3、FeCl3。
A、③④⑤ B、只有③⑤; C、只有②③⑤; D、只有①③⑤
5、用NA表示阿佛加德罗常数,下列说法错误的是( )
A.28g乙烯或丙烯完全燃烧均生成2NA CO2
B.1molCl2通入足量的NaOH溶液中充分反应转移的电子数为2NA
C.在标准状况下22.4L NH3含有原子数为4NA
D.2g H2所含原子数为2NA;
4、 在水溶液中,YO3n-和S2-发生如下反应:YO3n- + 3S2- + 6H+ = Y- + 3S↓+ 3H2O,则YO3n-中Y元素的化合价和原子最外层电子数分别为( )
A.+4、6 B.+7、7 C.+5、7 D.+5、5
3、2004年,美国科学家通过“勇气”号太空车探测出水星大气中含有一种称为硫化羰(化学式为COS)的物质,已知硫化羰与二氧化碳的结构相似,但能在氧气中完全燃烧,下列有关硫化羰的说法正确的是( )
A.1 mol硫化羰在氧气中完全燃烧时转移6mol电子; B.硫化羰可用作灭火剂
C.CO2和COS结构相似都是非极性分子; D.硫化羰熔点可能较高
2、下列仪器使用前不需要检查是否漏水的是( )
A、长颈漏斗 B、分液漏斗 C、滴定管 D、容量瓶
1、接触法制硫酸的接触室里有一个热交换器,关于它的作用比较确切的说法是( )
A、给催化剂加热;
B、把反应时生成的热,传递给需要预热的混合气体,并冷却反应后生成的气体;
C、为了提高反应温度,让热的水蒸气通过热交接器;
D、为了充分利用热,让冷水通过热交接器。
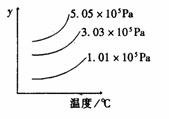
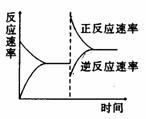
10. 用来表示可逆反应2A(气)+B(气) 2C(气)+Q的正确图象是
2C(气)+Q的正确图象是





 c% 100℃ V V正
V V逆
V 500℃
c% 100℃ V V正
V V逆
V 500℃




 500℃ V逆 V正 100℃
500℃ V逆 V正 100℃
时间 温度 P P
A B C D
 化学平衡图形题:
化学平衡图形题:
1 右图表示外界(温度、压强)的变化对下列反应的影响L(s)+3G(g)===2R(g)(正反应为热反应),在图中,y轴是指
A平衡混合物中R的百分含量 B 平衡混合物中G的百分含量
C G的转化率 D L的物质的量
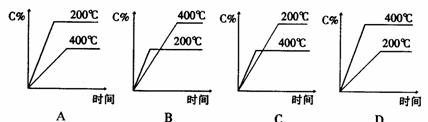
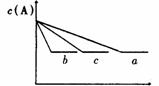 2 反应A(g)+B(g)===C(g)在密闭容器中进行。若存在三种情况:①200℃,无催化剂;②500℃无催化剂;③500℃有催化剂;情况①是曲线 ,情况②是曲线 ,情况③是曲线 ,
2 反应A(g)+B(g)===C(g)在密闭容器中进行。若存在三种情况:①200℃,无催化剂;②500℃无催化剂;③500℃有催化剂;情况①是曲线 ,情况②是曲线 ,情况③是曲线 ,
 3 右图是关于反应A2(g)+3B2(g)===2C(g)(正反应为放热反应)的平衡移动图形,影响平衡移动的原因是
3 右图是关于反应A2(g)+3B2(g)===2C(g)(正反应为放热反应)的平衡移动图形,影响平衡移动的原因是
A 升高温度,同时加压。 B降低温度,同时减压 C 增大反应物浓度,同时使用催化剂; D 增大反应物浓度,同时减小生成物浓度
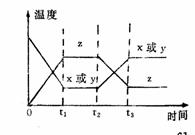
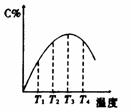 4 可逆反应A(g)+B(g)===2C(g)在不同的温度下经过一时间,混合物中C的体积分数与温度的关系如图所示,那么:⑴反应在 温度下达到平衡。⑵此反应的正反应为 热反应;⑶由T1向T2变化时正反应速率 逆反应速率(填>、<、=);⑷由T3向T4变化时正反应速率 逆反应速率(填>、<、=);
4 可逆反应A(g)+B(g)===2C(g)在不同的温度下经过一时间,混合物中C的体积分数与温度的关系如图所示,那么:⑴反应在 温度下达到平衡。⑵此反应的正反应为 热反应;⑶由T1向T2变化时正反应速率 逆反应速率(填>、<、=);⑷由T3向T4变化时正反应速率 逆反应速率(填>、<、=);
5 有一化学平衡mA(g)+nB(g)===PC(g)+qD(g),右图表示的转化率与压强、温度的关系。由此得出的正确结论是
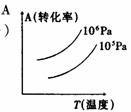 A 正反应是吸热反应,(m+n)>(p+q) B正反应是吸热反应,(m+n)<(p+q)
A 正反应是吸热反应,(m+n)>(p+q) B正反应是吸热反应,(m+n)<(p+q)
C正反应是放热反应,(m+n)>(p+q) D正反应是放热反应,(m+n)<(p+q)
6 对可逆反应A(g)+B(g)===C(g)(正反应为吸热反应),下列图像正确的是
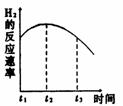
7 把镁条投入到有稀盐酸的试管,发现氢气产生的速率变化右图所示。其中t1→t2速率变化的主要原因是 ;t3 →t4速率变化的主要原因是
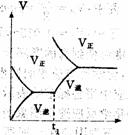 8 根据下列图象,推测相应改变的条件是( )
8 根据下列图象,推测相应改变的条件是( )
A 增大反应物浓度 B 增大生成物浓度 C 升高温度 D 加催化剂
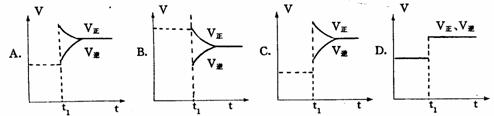 9 下列图象在t1时所对应的反应条件改变可能为:
9 下列图象在t1时所对应的反应条件改变可能为:
⑴升高温度 ⑵使用催化剂 ⑶增大反应物浓度 ⑷减少生成 物浓度
10 进行如下实验:在A锥形瓶中放入10g绿粒大的碳酸钙,在B锥形瓶中放入5g粉末状的碳酸钙,分别加入50ml 1mol/L盐酸。如下图(图中:X表示时间,Y表示锥形瓶中碳酸钙减少的质量)能正确表示实验结果的是( )
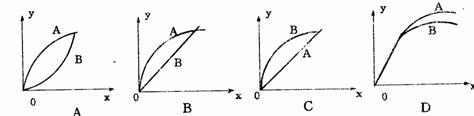
11
 下列图象在t1时所对应的反应条件改变可能为:
下列图象在t1时所对应的反应条件改变可能为:
⑴升高温度或增大压强 ⑵加催化剂 ⑶ 增大反应物浓度
12对于2A(g)+B(g)===2C(g)(正反应为放热反应),符合该反应的下列图象:
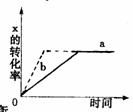 13 下图中a曲线表示一定条件下可逆反应X(g)+Y(g)====2Z(g)+W(S)(正反应为放热反应)的反应过程。若使a曲线变为b曲线,可采用的措施是
13 下图中a曲线表示一定条件下可逆反应X(g)+Y(g)====2Z(g)+W(S)(正反应为放热反应)的反应过程。若使a曲线变为b曲线,可采用的措施是
A 加入催化剂 B 增大Y的浓度 C 降低温度 D 增大体系压强
14 下图表示平衡混合物中X的体积分数在不同的压强下随温度变化的情况,在下述的平衡体系中,X可以代表横线标明的物质(反应中各物质均为气态)是( )
A N2+3H2===2NH3正反应为放热反应 B H2+I2===2HI正反应为放热反应
C 2SO3====2SO2+O2正反应为吸热反应 D 4NH3+5O2====4NO+6H2O正反应为吸热反应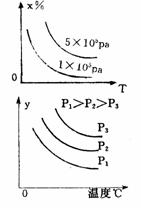
15 可逆反应L(S)+G(g)===2R(g)由右图分析Y所表示的量反应的能量变化为( )
A R的体积分数,正反应为放热反应 B G的体积分数,正反应为吸热反应
 C G的转化率,正反应为放热反应 D R的分解率,正反应为放热反应
C G的转化率,正反应为放热反应 D R的分解率,正反应为放热反应
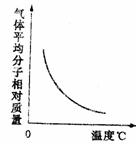
16 可逆反应2A+B===2C(g)正反应为放热反应,随温度变化气体平衡相对分子质量如图所示。则下列叙述正确的是
A A和B可能都是固体 B A和B一定都是固体 C 若B为固体则A一定为气体
D A和B可能都是气体
 17 在密闭容器中进行下列反应:M(g)+N(g)==R(g)+2L。此反应符合下列图象,R%为R在平衡混合物中的体积分数,该反应是( )
17 在密闭容器中进行下列反应:M(g)+N(g)==R(g)+2L。此反应符合下列图象,R%为R在平衡混合物中的体积分数,该反应是( )
A正反应为吸热反应 L是气体 B正反应为放热反应 L是气体
C正反应为吸热反应 L是固体 D正反应为放热反应 L是固体或液体
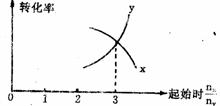 18 在一定条件下,将X和Y两种物质按不同的比例放入密闭容器中反应,达到平衡后,测得X,Y的转化率与起始时两物质的物质的量之比nx:ny的关系如图所示,则X和Y的反应方程式可表示为( )
18 在一定条件下,将X和Y两种物质按不同的比例放入密闭容器中反应,达到平衡后,测得X,Y的转化率与起始时两物质的物质的量之比nx:ny的关系如图所示,则X和Y的反应方程式可表示为( )
A 3X+Y===Z B 2X+Y===Z C X+3Y===Z D 3X+Y ===2Z
 19今有X(g)+Y(g)====2Z(g)正反应为放热反应,从反应开始经过t1S后达到平衡状态t2S时,由于条件改变,平衡受到破坏,在t3S时又到平衡。根据右图回答:从t2S到t3S间的曲线变化是由哪种条件引起的
19今有X(g)+Y(g)====2Z(g)正反应为放热反应,从反应开始经过t1S后达到平衡状态t2S时,由于条件改变,平衡受到破坏,在t3S时又到平衡。根据右图回答:从t2S到t3S间的曲线变化是由哪种条件引起的
A 增大X或Y的浓度 B 增在压强 C 增大Z的浓度 D 升高温度
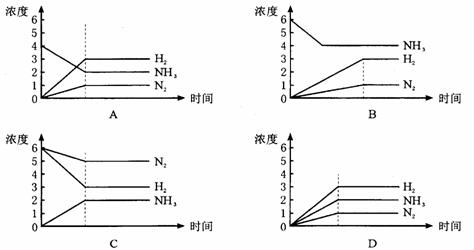 20下图表示反应:N2+3H2===2NH3建立平衡的过程,如果用纵坐标表示物质的量浓度,横坐标表示时间来绘制这一反应的图形,则下列图形中一举正确的是
20下图表示反应:N2+3H2===2NH3建立平衡的过程,如果用纵坐标表示物质的量浓度,横坐标表示时间来绘制这一反应的图形,则下列图形中一举正确的是
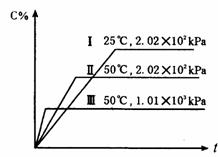 21在一密闭容器中进行如下反应:A(g)+B(g)====2C(g)+2D,此反应符合右图(其中C%是混合物中C的质量分数,t为反应时间)对此反应的叙述正确的是
21在一密闭容器中进行如下反应:A(g)+B(g)====2C(g)+2D,此反应符合右图(其中C%是混合物中C的质量分数,t为反应时间)对此反应的叙述正确的是
A 正反应为吸热反应,D是固体; B 正反应为吸热反应,D是气体;
C 正反应为放热反应,D是固体或液体;, D 正反应为放热反应,D是气体;
答案:1 A、C; 2 a、c、b; 3 D;4 T3 、、放、>、< ;5 A; 6 D ;7 该反应是放热的使溶液的温度升高,故反应速率加块;C(H+)不断减少,减少了反应物浓度,反应速率减少;8 A;9 C、D、A、B
10 C、;11 B、C、A; 12 A、C; 13 A;14 A; 15 A、C;16 B、C; 17 C; 18 A、D;19 D; 20 A、C;21 D;
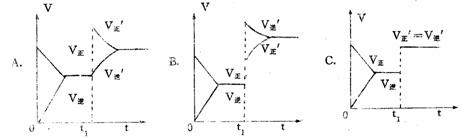
9. 在密闭容器里通A、B两种气体,发生如下可逆反应A(气)+2B(气)  2C(气)+2D(气)+Q(Q<0),下列示意图正确的是( )
2C(气)+2D(气)+Q(Q<0),下列示意图正确的是( )


 V A% c% 300℃ 浓度
V A% c% 300℃ 浓度





 V正 V逆
500℃ 100℃
D
V正 V逆
500℃ 100℃
D



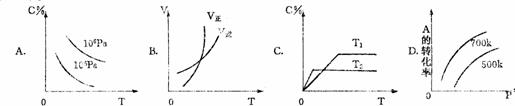
 1×107Pa
1×107Pa

 1×106Pa A
1×106Pa A
 温度 时间 压强 时间
温度 时间 压强 时间
A B C D
8.在容积相同的不同容器中,分别充入同量的N2和H2,在不同的温度
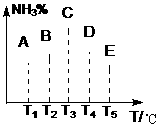 体积,发生反应N2 +H2
体积,发生反应N2 +H2 2NH3,并在第7秒时分别测定其中NH3的体积分数并绘成如图曲线。
2NH3,并在第7秒时分别测定其中NH3的体积分数并绘成如图曲线。
(1).A、B、C、D、E五点中,尚未达到化学平衡的点是:
(2).可逆反应的正反应是 (填“吸”或“放”)热反应;
(3).AC段,曲线是增函数曲线,CE曲线是减函数曲线。试从化学反应速率和化学平衡角度说明理由
。
(4).由T1向T2变化时,v正 v逆(填>、<、=)。由由T3向T4变化时,v正 v逆(填>、<、=)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com