
题目列表(包括答案和解析)
25、有原子序数依次增大的A、B、C、D、E五种短周期元素,它们可两两组成甲、乙、丙、丁四种化合物,各化合物中原子个数比关系如下表:
|
|
甲 |
乙 |
丙 |
丁 |
|
化合物中各元素原子个数比 |
A∶C=1∶1 |
B∶A=1∶2 |
D∶E=1∶3 |
B∶E=1∶4 |
其中A、B两种原子的核电荷数之差等于它们的原子最外层电子数之和;B原子最外层电子数比其次外层电子数多2个;在周期表中,C是E的邻族元素,化学性质活泼;D和E位于同一周期,且D和E的原子序数之和为30。
(1)D和E同属哪一周期元素? ,推断依据是 。
(2)根据题目提供的条件,推断E在周期表中的族序数所必要的条件是 。
(3)向甲的水溶液中加入MnO2,反应的化学方程式: 。
(4)已知乙的相对分子质量小于甲。在实验室常用什么方法制得乙?(用化学方程式表示) 。
(5)丙的水溶液呈酸性,与饱和NaHCO3溶液反应会迅速产生大量气体和难溶物,有关离子方程式是 。
(6)向30mL1mol/LKI溶液中依次注入下列试剂:
①1mL5mol/L盐酸 ②0.5mol/L30%甲溶液 ③1mL丁。经充分振荡后,静置,可得一紫色溶液。这种紫色溶液是 。
24、(1)常温下,高锰酸钾跟浓盐酸反应,可生成氯气,同时MnO4-被还原成Mn2+。写出这一氧化还原反应的离子方程式 。
(2)将H2S跟浓HNO3溶液反应,当HNO3过量时,H2S的氧化产物是H2SO4,反应物HNO3的还原产物是NO,生成物中还有水,写出这一反应的化学方程式 。
如反应中有2.4mol电子转移时,生成的NO在标准状况下的体积是 L,这些NO全部被氧化为NO2,需O2的体积为 L(标准状况)。
23、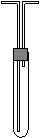 利用图1所示装置收集以下8种气体(图中试管的位置不得变化):A B
利用图1所示装置收集以下8种气体(图中试管的位置不得变化):A B
a.H2,b.Cl2,c.CH4,d.HCl, e.NH3,f.NO, g.H2S,h.SO2
①若烧瓶是干燥的,则由B口进气可收集的气体有
(写序号下同)。
②若烧瓶充满水,可收集的气体有 ,这时气体由 口进入。
③若烧瓶是干燥的,则A口进气,可收集的气体有 。
④若在烧瓶内装入浓硫酸进行气体干燥,则可用此装置来干燥的气体有 ,
这时气体由 口进入。
22、纳米材料的表面粒子占总粒子数比例极大,这是它有许多特殊性质的原因。假设某氯化钠纳米颗粒的大小和形状恰好与氯化钠晶胞的大小和形状相同(如右图所示),则这种纳米颗粒的表面粒子数
 与总粒子数的比值为:
与总粒子数的比值为:
A、7:8 B、13:14 C、25:26 D、26:27
第Ⅱ卷(共84分)
21、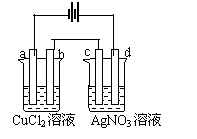 如右图,以惰性电极材料为电极进行电解,在a、b、c、d各
如右图,以惰性电极材料为电极进行电解,在a、b、c、d各
电极上析出生成物的物质的量比例关系正确的是:
A、1:1:1:1 B、2:2:1:1
C、2:2:4:1 D、1:2:2:4
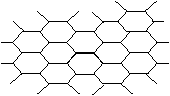
20、石墨晶体结构如下图所示:
每一层由无数个正六边形构成,则平均每个正六边所含的碳原子数为:
A、6 B、4
C、3 D、2
19、在一个固定容积的密闭容器中加入2mol A和1mol B,发生反应:
2A(g) + B(g)  3C(g)
+ D(g)达到平衡时,C的浓度为w
mol/L。若维持容器的容积和温度不变,按下列4种情况配比为开始浓度,达到平衡后,C的浓度仍为w mol/L的是
3C(g)
+ D(g)达到平衡时,C的浓度为w
mol/L。若维持容器的容积和温度不变,按下列4种情况配比为开始浓度,达到平衡后,C的浓度仍为w mol/L的是
A、4mol A + 2mol B B、3mol C + 1mol D
C、2mol A+1molB+3molC+1molD D、1molA+0.5molB+1.5molC+0.5molD
18、为更好地表示溶液的酸碱性,科学家提出了酸度(AG)的概念,AG=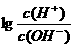 ,则下列叙述正确的是( )
,则下列叙述正确的是( )
A、中性溶液的AG=0 B、酸性溶液的AG<0
C、常温下0.1mol/LNaOH溶液的AG=12 D、常温下0.1mol/L盐酸溶液的AG=12
17、工业制硫酸时,进入接触室的气体组成为:SO2占7%,O2占11%,N2占82%。据测定,一定体积的混和气体进入接触室后,体积变化为原来的97.2%,则SO2转化率是:
A、50% B、60% C、75.3% D\80%
16、已知在酸性溶液中,下列物质氧化KI时,自身发生如下变化:
Fe3+→Fe2+;MnO4-→Mn2+;Cl2→Cl-;HNO3→NO
如果分别用等物质的量的这些物质氧化足量的KI,得到I2最多的是:
A、Fe3+ B、MnO4- C、Cl2 D、HNO3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com