
题目列表(包括答案和解析)
17. X、Y、Z、W均为短周期元素,它们在周期表的位置如图所示,若W原子的最外层电子数是内层电子总数的 ,下列说法中正确的是 ( )
,下列说法中正确的是 ( )
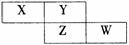 A.阴离子的半径从大到小排列顺序为:X > Y > Z > W
A.阴离子的半径从大到小排列顺序为:X > Y > Z > W
B.X、Y、Z、W元素的氢化物分子间都可以形成氢键
C.Y的两种同素异形体在常温下可以相互转化
D.最高价氧化物对应的水化物的酸性:W > Z
16.有一瓶无色气体可能含有CO2、HBr、HCl、SO2中的一种或几种。将此气体通入稀氯水中,恰好完全反应,得无色透明溶液,把此溶液分成两份,分别加入盐酸酸化了的BaCl2溶液和硝酸酸化了的AgNO3溶液,均出现白色沉淀,以下结论正确的是 ( )
A.原气体中肯定有SO2 B.原气体中肯定有HCl
C.原气体中肯定没有CO2 D.原气体中肯定没有HBr
15.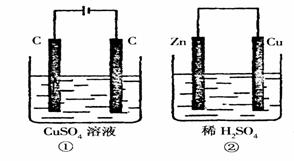 如图所示的两个实验装置中,溶液的体积均为200mL,开始时电解质溶液的浓度均为0.lmol/L,工作一段时间后,测得导线中均通过0.02mol电子,若不考虑盐的水解和溶液体积的变化,则下列叙述中正确的是. ( )
如图所示的两个实验装置中,溶液的体积均为200mL,开始时电解质溶液的浓度均为0.lmol/L,工作一段时间后,测得导线中均通过0.02mol电子,若不考虑盐的水解和溶液体积的变化,则下列叙述中正确的是. ( )
A.产生气体的体积:①>②
B.电极上析出物质的质量: ①>②
C.溶液的pH变化:①增大,②减小
D.电极反应式:
①中阳极: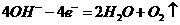 ;
;
②中阳极: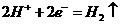
14.下列离子方程式书写正确的是 ( )
A.等体积等物质的量浓度的氢氧化钡稀溶液与碳酸氢铵稀溶液混合
Ba2+ + 2OH- + NH4+ + HCO3- = BaCO3↓+ NH3·H2O + H2O
B.氯化铝溶液中加入过量的氨水
Al3+ + 4NH3·H2O = 4NH4+ + AlO2 -+ 2H2O
C.向次氯酸钙溶液中通入过量的二氧化硫
Ca2+ + 2ClO- + SO2 + H2O = CaSO3↓+ 2HClO
D.碳酸钠溶液中加入过量的苯酚
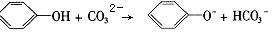
13、据报道,某地一辆装载有砒霜的货车因故滑下河道,部分砒霜散落到河中。砒霜的主要成分是As2O3,剧毒,可用于制造杀虫剂和灭鼠剂等。As2O3是两性偏酸性氧化物,其无色晶体在193℃升华,微溶于水生成H3AsO3;其对应的盐也有毒性。其中碱金属对应的盐易溶于水,其他金属对应的盐几乎不溶于水。根据以上信息,下列说法正确的是 ( )
A. As2O3是砷的最高价含氧酸的酸酐
B. B.As2O3的晶体为分子晶体
C.可向河水中投入纯碱,以消除对河水的污染
D.可向河水中撒入生石灰,以消除对河水的污染
12. NaCl晶体中最小重复单元(晶胞)如右图所示。已知:氯化钠的摩尔质量为
M g/mol,某一定条件下NaCl晶体中最邻近的钠离子和氯离子中心间的距离为a cm,晶体的密度为 b g/cm3 。则下列叙述正确的是 ( )
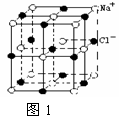 A.每个Na+ 周围最近且等距离的Cl-所围成的空间构型为正六面体
A.每个Na+ 周围最近且等距离的Cl-所围成的空间构型为正六面体
B. 每个Na+ 周围最近且等距离的Cl-所围成的空间构型为正八面体
C. 阿伏加德罗常数NA可表示为M/2a3b
D. 阿伏加德罗常数NA可表示为4M/a3b
11.用NA表示阿伏加德罗常数,下列叙述中正确的是 ( )
A. 12g的金刚石晶体中含有碳碳键的数目为4NA
B.46g四氧化二氮含有的原子总数为3NA
C. 500mLl.0mol/L的乙酸溶液中含有的H+数为0.5NA
D.1 molFeCl3制成胶体所得胶体的粒子数为NA
10.已知I-、Fe2+、SO2、Cl-和H2O2均具有还原性,它们在酸性溶液中还原性的强弱顺序是Cl-< Fe2+<H2O2< I-<SO2 ,则下列反应中不能发生的是 ( )
A、2Fe3++SO2+2H2O 2Fe2++SO42-+4H+
B、SO2+I2+2H2O H2SO4+2HI
C、H2O2+H2SO4 SO2↑+O2↑+2H2O
D、2Fe2++I 2 2Fe3++2 I-
26.(12分)取25.0gCuSO4·5H2O晶体,加热使之均匀缓慢升温至1000℃,并恒温1小时,将带火星的木条插入产生的气体中,木条可以复燃。试通过计算回答下列问题。(已知:在1000℃时,Cu+比Cu2+稳定。)
以下是加热过程中发生的化学反应:
CuSO4·5H2O CuSO4+5H2O↑ CuSO4
CuSO4+5H2O↑ CuSO4 CuO+SO3↑
CuO+SO3↑
4CuO 2Cu2O+O2↑
2SO3
2Cu2O+O2↑
2SO3 2SO2+O2
2SO2+O2
⑴充分反应后,最终固体产物颜色为_______________,其质量为_____________g。
⑵在某中间温度时,固体产物质量能否为10g?____________(填能或不能)。如可能,请计算其组成和质量,如不可能,请说明理由:
_________________________________________________________________________。
⑶如果某同学在做此实验时,最后得到固体质量为7.6g,试计算该固体的组成和质量
⑷不考虑实验带来的误差,在该反应条件下最终生成气态产物除去水后,物质的量可能为_____________。
A.0.10mol B.0.15mol C.0.20mol
南京市2005-2006学年度第一学期期末调研测试卷
25.(6分)碳酸钠和碳酸氢钠的固体混合物2.74g在坩锅中加热至固体质量不再减少为止,残留固体2.12g。将残留固体与盐酸完全反应,消耗盐酸20mL,得NaCl溶液。
求⑴原混合物中碳酸钠的物质的量。⑵盐酸的物质的量浓度。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com