
题目列表(包括答案和解析)
1.石油是一种重要能源,人类正面临着石油短缺、油价上涨的困惑。以下解决能源问题的方法不当的是
A.用木材作燃料 B.用液氢替代汽油
C.开发风能 D.开发地热能
27、(11分)为了测定溶液中Ba2+的浓度,做了以下实验:
①称取0.1323gK2Cr2O7溶于适量的稀硫酸中,再向其中加入过量的KI溶液与之反应,反应后的溶液加入27.00mLNa2S2O3溶液时恰好反应完全。
②另取50.00mLBa2+溶液,控制适当的酸度,加入足量K2CrO4的溶液,得BaCrO4沉淀,沉淀经过滤、洗涤后,用适量稀盐酸溶解,使CrO 转化Cr2O
转化Cr2O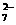 ,再加入过量KI与之反应,反应后再同上述 Na2S2O3溶液反应,反应完全时,消耗Na2S2O3溶液24.00mL,与之有关反应式如下:
,再加入过量KI与之反应,反应后再同上述 Na2S2O3溶液反应,反应完全时,消耗Na2S2O3溶液24.00mL,与之有关反应式如下:
□
Cr2O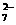 +□I-+□H+--□Cr3++□I2+□H2O
+□I-+□H+--□Cr3++□I2+□H2O
□I2+□S2O --□S4O
--□S4O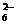 +□I-
+□I-
(1)配平离子方程式。
(2)上述两步可用_________________作指示剂,其现象_____________________________ 。
(3)试计算溶液中Ba2+的物质的量浓度
26.(8分)铁粉和铜粉的均匀混合物,平均分成四等份,分别加入同浓度的稀硝酸,充分反应后,在标准状况下生成NO的体积与剩余金属的质量如下表(设硝酸的还原产物只有NO):
|
实验编号 |
1 |
2 |
3 |
4 |
|
稀硝酸体积(mL) |
100 |
200 |
300 |
400 |
|
剩余金属(g) |
18.0 |
9.6 |
0 |
0 |
|
NO体积(L) |
2 .24 |
4 .48 |
6 .72 |
V |
试通过计算填空:
(1)硝酸的浓度为
(2)2中溶解了 g Fe
(3)3中溶解了 g Cu
(4)4中 V=
24.(9分)2004年是俄国化学家马尔柯夫尼柯夫(V.V.Markovnikov,1838-1904)逝世100周年。马尔柯夫尼柯夫因为提出碳碳双键的加成规则而闻名于世,该规则是指不对称的烯烃与HX或HCN加成时,氢总是加到含氢较多的双键碳原子上。
已知:CH3CH2CN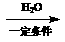 CH3CH2COOH
CH3CH2COOH
以下是某有机物F的合成路线,请填写下列空白。

(1)写出下列物质的结构简式A___________,C____________。
(2)反应①的反应类型是__________,反应②的反应类型是___________。
(3)写出③的化学方程式__________________________________________。
(4)写出与D互为同分异构体、结构中含有苯环且苯环上含有一个甲基(苯环上的取代基处于对位)的酯类的结构简式
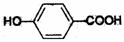 25.(11分)A、B、C、D均为含苯环的化合物,且式量B>A>C,已知有机物A的结构简式为
25.(11分)A、B、C、D均为含苯环的化合物,且式量B>A>C,已知有机物A的结构简式为
(1)A既能与NaOH溶液反应,又能与NaHCO3溶液反应,写出A和NaHCO3溶液反应的化学方程式
(2)有机物B在浓H2SO4存在下,相互作用生成一种环状酯,如图
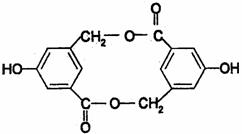
则有机物B的结构简式为 ,等物质的量B与Na、NaOH、NaHCO3充分反应,消耗Na、NaOH、NaHCO3的物质的量之比为 。
(3)D和B互为同分异构体,且苯环上的一氯代物只两种,D不与NaHCO3反应,能与Na、NaOH反应,等质量的D消耗Na、NaOH的物质的量之比为2:3,则D的结构简式为(只写一种):
(4)1molA、C完全燃烧,消耗O2的质量相等,且1molC能和1molNa完全反应,写出含碳原子数最少的C的结构简式
23. (11分)下图表示各物质之间的转化关系。已知:A、D、F、H均为单质,X常温下为无色液体,B为淡黄色固体,J溶于酸得到黄色溶液。
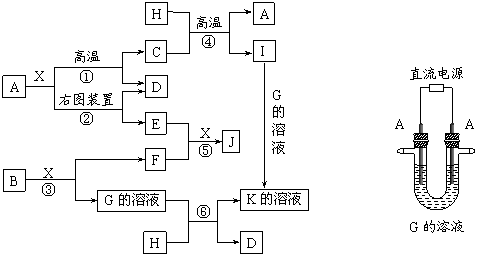




请按要求填空:
⑴写出B的电子式:______________________。
⑵写出用A作电极电解G溶液,在电极上生成E的反应式:_______________________,反应⑤的现象是___________________________ __ 。
⑶反应①的化学方程式是___________________________________,反应④在生产中有重要应用,被称为____________________反应。
⑷反应⑥的离子方程式是__________________________________________
22.(10分)已知A、B、C、D、E为中学常见的五种物质,均含元素Y,有的还可能含有元素X、Z,元素X、Y、Z的原子序数依次递增。
①元素Y在A、B、C、D、E中所呈化合价依次递增,其中只有B为单质。
②常温下将气体D通入水中发生反应,生成C和E。
③工业上以A、空气和水为原料,通过催化氧化法制成E。
请回答以下问题:
(1)A分子的空间构型是 ;B分子的电子式为 ;含Y元素的氧化物且属于酸酐还有:________ 。
(2)写出②中反应的化学方程式: 。
(3)由B反应生成1molA放出的热量为46.2kJ,写出该反应的热化学方程式:
__________________________________________________________________________
(4)工业上,若输送Cl2的管道漏气,用A进行检验时可观察到大量白烟,同时有B生成,写出有关反应化学方程式: ;若反应有6NA ( NA表示阿伏加德罗常数)电子发生转移,则有 mol的A被氧化。
21.(14分)固体AlCl3和FeCl3混合物中含有少量FeCl2和Al2(SO4)3。某同学设计如下实验进行分离,以分别得到纯净的AlCl3和FeCl3固体。
回答下列问题:
(1) 写出下列试剂的名称:试剂c___________, 试剂d__________,试剂f ,
(2) 操作3是 __________________ __ ,
(3) 操作4 _______________________________ _ ,
(4) 加入试剂b(一种气体单质的水溶液)的目的是__________________________ ,溶液E中的溶质有:_________________________________。其中杂质可以不用另加试剂除去,其原因是_______________________________ ;有同学认为上述实验中最后得到AlCl3和FeCl3固体的步骤不科学,他的理由是:
.

20.(10分) “过氧乙酸”是抗“非典”中广泛用于医院、地面、门窗、汽车等方面的消毒液。下面是市售过氧乙酸商品标签:
|
过氧乙酸 本品包括甲、乙两种溶液,体积各500mL,把甲、乙溶液各1份在玻璃容器中混合后放置24小时后,其中过氧乙酸浓度不少于10%,应用50倍纯水稀释(浓度为0.2%)稀释后才能使用。 |
有关资料:H2O2是极弱的电解质,在酸性介质中才能稳定存在,是一种强氧化剂。过氧乙酸消毒液是由H2O2、H2O、CH3COOH及少量H2SO4混合后,反应生成过氧乙酸(CH3COOOH),反应的化学方程式CH3COOH+ H2O2→CH3COOOH + H2O。 CH3COOOH容易放出原子氧,它与空气中微生物机体作用,达到灭菌目的,是消毒液的主要成份。
(1)某研究性学习小组为了弄清配制过氧乙酸消毒液的甲、乙溶液的主要成分各是什么?进行以下科学探究,请你完成下列相关内容:
① 提出假设:甲溶液的主要成分为
乙溶液的主要成分为 。
②实验验证:取甲、乙两种溶液少许,分别加入几滴 试液,甲溶液
的现象为 ,乙溶液的现象为 。
③得出结论:甲溶液的主要成分为
乙溶液的主要成分为 。
(2)该校根据“非典”消毒要求,急需配制0.2%过氧乙酸消毒液1m3,需要购进甲溶液_________瓶,乙溶液____________瓶。
19.将0.2mol/L的KOH溶液与0.lmol/L的H2SO3溶液等体积混合后,溶液中各粒子浓度大小关系正确的是 ( )
A.c(K+)+c(H+)=c(OH-)+c(HSO3-)+c(SO32-)
B.c(K+)+c(OH-)=c(H+)+2c(SO32-)+3c(HSO3-)+4c(H2SO3)
C.c(K+)>c(SO32-)>c(HSO3-)>c(OH-)> c(H+)
D.c(SO32-)+c(HSO3-)+c(H2SO3)=0.lmol/L
18. 一定条件下,向一带活塞的密闭容器中充入2mol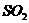 和1mol
和1mol ,发生下列反应:
,发生下列反应:

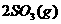 达到平衡后改变下述条件,
达到平衡后改变下述条件,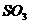 气体平衡浓度不改变的是
气体平衡浓度不改变的是
A. 保持温度和容器体积不变,充入
B. 保持温度和容器内压强不变,充入
C. 保持温度和容器内压强不变,充入
D. 保持温度和容器内压强不变,充入
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com