
题目列表(包括答案和解析)
4.下列各组离子一定能大量共存的是 ( )
A.含有大量Fe3+的溶液中:NH4+、Na+、Cl-、SCN-
B.在强碱溶液中:Na+、K+、AlO2-、CO32-
C.在c(H+)=10-13mol·L-1的溶液中:NH4+、Al3+、SO42-、NO3-
D.在pH=1的溶液中:K+、Fe2+、Cl-、NO3-
2.下列叙述中正确的是 ( )
A.离子晶体中肯定不含非极性共价键
B.原子晶体的熔点肯定高于其他晶体
C.由分子组成的物质其熔点一定较低
D.原子晶体中除去极性共价键外不可能存在其他类型的化学键
|
3CO,下列叙述正确的是YCY ( )
A.在氮化铝的合成反应中,N2是还原剂,Al2O3是氧化剂
B.上述反应中每生成2molAlN,N2得到3mol电子
C.氮化铝中氮元素的化合价为-3价
D.氮化铝晶体属于分子晶体
1.下列各组物质各自形成的晶体,均属于分子晶体的化合物的是 ( ) A.NH3,HD,C10H8 B.PCl3,CO2,H2SO4
C.SO2,SiO2,P2O5 D.CCl4,Na2S,H2O2
28.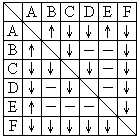 (本小题10分)有A、B、C、D、E、F六瓶未知溶液.它们是MgSO4、BaCl2、(NH4)2CO3、AgNO3、HBr和NaOH.为了鉴别,各取少许溶液进行两两混和试验,结果如右表.表中"↓"表示有沉淀或生成微溶化合物,"↑"表示有气体生成,"-"表示观察不到明显的现象变化。
(本小题10分)有A、B、C、D、E、F六瓶未知溶液.它们是MgSO4、BaCl2、(NH4)2CO3、AgNO3、HBr和NaOH.为了鉴别,各取少许溶液进行两两混和试验,结果如右表.表中"↓"表示有沉淀或生成微溶化合物,"↑"表示有气体生成,"-"表示观察不到明显的现象变化。
(1)请写出下列物质的化学式:
C 、D 、E 、F .
(2)写出A、B反应的离子方程式: _____________________________________________。
新星高级中学2006-2007学年高三统一考试
27.(10分)归纳整理是科学学习的重要方法之一。在学习了氧族元素的各种性质后,可归纳整理出如下所示的表格(部分)。
|
性质\元素 |
8O |
16S |
34Se |
52Te |
|
单质熔点(℃) |
-218.4 |
113 |
|
450 |
|
单质沸点(℃) |
-183 |
444.6 |
685 |
1390 |
|
主要化合价 |
-2 |
-2,+4,+6 |
-2,+4,+6 |
|
|
原子半径 |
逐渐增大 |
|||
|
单质与H2反应情况 |
点燃时易化合 |
加热化合 |
加热难化合 |
不能直接化合 |
请根据上表回答下列问题:
(1)硒的熔点范围可能是
(2)碲的化合价可能有
(3)硫、硒,碲的氢化物水溶液的酸性由强至弱的顺序是 (填化学式)。
(4)氢硒酸有较强的_________(填“氧化性”或“还原性”),因此放在空气中长期保存易变质,其可能发生的化学方程式为_________________________________。
 (5)工业上Al2Te3可用来制备H2Te,完成下列化学方
(△E)
(5)工业上Al2Te3可用来制备H2Te,完成下列化学方
(△E)
程式:
 A12Te3 + ( )
A1(OH)3↓ + H2Te↑
A12Te3 + ( )
A1(OH)3↓ + H2Te↑
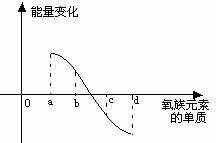
(6)右图所示为氧族元素单质与H2反应过程中的能
量变化示意图,其中a、b、c、d分别表示氧族中某
一元素的单质,△E为相同物质的量的单质与H2反应
过程中的能量变化(反应的热效应)。则:b代表 ,d代表 (均写单质名称)。
26.(9分)
(1)航天飞机曾用金属铝粉和高氯酸铵混合物作为固体燃料。加热铝粉使其氧化并放出大量热量,促使混合物中另一种燃料分解。m mol高氯酸铵分解时除产生2m mol水蒸气和m mol氧气外,其他组成元素均以单质形式放出,因而产生巨大的推动力。
写出其中涉及到的化学方程式:
;
。
(2)高氯酸铵作为火箭燃料的重要氧载体。高氯酸铵在高压、450℃的条件下迅速分解生成水蒸气、氮气、氯化氢和氧气。
①写出此反应的化学方程式 。
②反应中生成的氧化产物与还原产物的物质的量之比是 ,
每分解1mol高氯酸铵,转移的电子数目是 。
25.(10分)短周期元素A、B、C、D中,0.5molA元素的离子得到的6.02×1023个电子后被还原为中性原子;0.4克A的氧化物恰好与100mL 0.2mol/L的盐酸完全反应;A元素原子核内质子数与中子数相等。B元素原子核外电子数比A元素原子核外电子数多1;C-离子核外电子层数比A元素的离子核外电子层数多1;D元素原子最外层电子数是次外层的2倍。请填写下列空格:
(1)推断A、B、C、D四种元素的符号A ;B ;C ;D ;
(2)C-1离子的原子结构示意图 ;
(3)D元素的最高价氧化物的结构式是: ;
(4)C、D元素组成的物质,分子内含有 键(填“极性”或“非极性”,下同),其分子为 分子。
(5)用电子式表示A、C两元素形成的化合物: 。
24.(13分)已知主族元素X、Y、Z、W是分布于元素周期表中三个短周期里的非金属元素,其原子序数依次增大。W原子的质子数是Y原子质子数的两倍,X原子与W原子的最外层电子数之和是Y和Z原子的质子数之和的1/3。Y的氢化物分子中有三个共价键。
(1)X、Y、Z、W的元素名称分别是 、 、 、 。
(2)Y的氢化物分子属于 分子(填“极性”或“非极性”),Y的氢化物的沸点比相邻同主族元素氢化物的沸点高,其原因是 。Y的氢化物与质子反应的产物的电子式为 ,此产物的空间形状呈 。
(3)由以上任意三种元素组成的化合物中,其水溶液显酸性的有(填写化学式) 、 、 。
(4)我国材料学家已成功制备了W元素与Y元素组成的耐高温的新型材料W3Y4。工业上可用W的氢化物与Y的氢化物反应制得该耐高温化合物和氢气,此反应的化学方程式为 。
23.(10分)四氯化钛(TiCl4)是工业上制备金属钛的重要原料。常温下,它是一种极易水解的无色液体,沸点为136.4℃。工业制备TiCl4和钛的反应分布为:
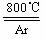 TiO2 +2C+2Cl2
TiO2 +2C+2Cl2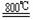 TiCl4 +2CO ;TiCl4
+2Mg
Ti + 2MgCl2
TiCl4 +2CO ;TiCl4
+2Mg
Ti + 2MgCl2
下图是实验室制备TiCl4的反应装置,主要操作步骤:
①连接好整套装置,在通Cl2前先通入CO2气体并持续一段时间;
②当锥形瓶中TiCl4的量不再增加时,停止加热,从侧管中改通CO2气体直到电炉中的瓷管冷却为止;
③将TiO2、炭粉混合均匀后,装入管式电炉中;
④ 将电炉升温到800℃,一段时间后改通Cl2,同时在冷凝管中通冷凝水。
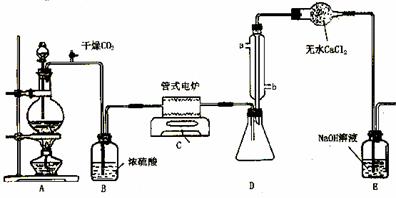
试回答下列问题:
⑴ 正确的操作顺序为(填序号)___________________________ 。
⑵ 装置A中的反应的离子方程式为__________________________________ 。
⑶ 操作①的目的是_________________________________ 。
⑷ 装置D中冷凝管进水口的位置是(填a或b)__________ ,
装置E的作用是___________________________________________________ 。
⑸ TiCl4露置于空气中极易水解,其化学方程式可表示为_____________________ 。
⑹ 工业上常用金属镁在800℃高温和氩气氛围中还原TiCl4的方法制备钛,
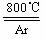 TiCl4 +2Mg Ti +
2MgCl2 ,氩气的作用为__
。
TiCl4 +2Mg Ti +
2MgCl2 ,氩气的作用为__
。
22.(10分)硫酸工厂周围的空气中有较多的二氧化硫。某研究学习小组为了测定空气中二氧化硫的体积分数设计了如下两个方案:
方案一:取标准状态下的空气V L(内含N2、O2、CO2、SO2等),缓慢通过足量溴水,在所得的溶液中加入过量的氯化钡溶液后,过滤,将沉淀洗涤、干燥,称得其质量为m g.请回答:
(1)加入过量的氯化钡溶液的目的是 。
(2)过滤后,若在滤液中加入硫酸钠溶液,有白色沉淀产生,说明
。
(3)过滤后,一般要用蒸馏水洗涤沉淀2-3次,以除去附在沉淀上的可溶性物质。请说明应通过什么方法验证可溶物质是否已被除尽(要求:实验过程、使用的试剂、现象及结论)。
__________________________________________________________________________________________________________________________________________________________________________
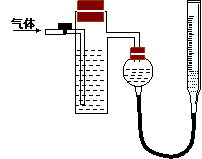 方案二:采用如右图所示装置,装置中反应管内装有碘的淀粉溶液。按设计意图,将空气(内含N2、O2、CO2、SO2等)通过此装置时,其中的SO2被吸收,量气管内增加的体积为其余气体的体积。
方案二:采用如右图所示装置,装置中反应管内装有碘的淀粉溶液。按设计意图,将空气(内含N2、O2、CO2、SO2等)通过此装置时,其中的SO2被吸收,量气管内增加的体积为其余气体的体积。
(4)反应管内溶液蓝色消失后,没有及时停止通气,则测得的SO2的含量 (选填“偏高”“偏低”或“不受影响:)。
(5)反应管内的碘的淀粉溶液可以用下列的 (填代号)代替:
A.NaOH溶液 B.酸性KMnO4溶液 C.Na2SO3溶液 D.BaCl2溶液
(6)若碘溶液体积为VamL ,浓度为c mol·L-1。剩余气体的体积为VbmL(已折算成标准状态下的体积)。用c、Va、Vb表示SO2的体积分数为:
(7)研究小组经过讨论发现方案二的设计中有一个明显的缺陷影响了测定结果(不属于操作错误),你认为是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com