
题目列表(包括答案和解析)
24.(12分)将4 mol SO3气和4 mol NO置于2 L容器中,一定条件下发生如下可逆反应(不考虑NO2和N2O4之间的相互转化): 2SO3(g) 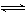 2SO2+O2 2NO+O2
2SO2+O2 2NO+O2 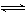 2NO2
2NO2
(1)当上述系统达到平衡时,O2和NO2的物质的量分别为n(O2)=0.1 mol、n(NO2)=3.6 mol,则此时SO3气体的物质的量为 。
(2)当上述系统达到平衡时,欲求其混合气体的平衡组成,则至少还需要知道两种气体的平衡浓度,但这两种气体不能同时是SO3和 ,或NO和 (填它们的分子式)。
(3)若在另外一个2 L的容器中只发生反应2NO+O2 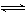 2NO2,其中NO、O2、NO2的起始浓度依次是0.2 mol/L、0.1 mol/L、0.2 mol/L,当反应达到平衡时,各物质的浓度可能是 (填字母代号)
。
2NO2,其中NO、O2、NO2的起始浓度依次是0.2 mol/L、0.1 mol/L、0.2 mol/L,当反应达到平衡时,各物质的浓度可能是 (填字母代号)
。
A、c(NO)=0.35 mol/L或c(NO)=0.09 mol/L B、c(NO2)=0.4 mol/L
C、c(NO2)=0.35 mol/L D、c(O2)=0.2 mol/L或c(NO)=0.4 mol/L
江苏省苏州中学2006-2007学年度第一学期期初考试
模拟试题 化 学 答卷纸
班级_______ 学号_______ 姓名_____________ 成绩_______
23.(10分)CO、CH4均为常见的可燃性气体。
(1)等体积的CO和CH4在相同条件下分别完全燃烧,转移的电子数之比是 。
(2)已知在101 kPa时,CO的燃烧热为283 kJ/mol。相同条件下,若2 molCH4完全燃烧生成液态水,所放出的热量为1 mol CO完全燃烧放出热量的6.30 倍,CH4完全燃烧反应的热化学方程式是: 。
(3)120℃、101 kPa下,a mL由CO、CH4组成的混合气体在bmL O2中完全燃烧后,恢复到原温度和压强。
①若混合气体与O2恰好完全反应产生b mL CO2,则混合气体中CH4的体积分数为 (保留2位小数)。
② 若燃烧后气体体积缩小了a/4 mL ,则a与b关系的数学表示式是 。
22.(8分)氨是最重要的氮肥,是产量最大的化工产品之一。课本里介绍的合成氨技术叫哈伯法,是德国人哈伯在1905年发明的,其合成原理为:N2(g)+3H2(g) 2NH3(g);△H= -92.4kJ/mol他因此获得了1918年诺贝尔化学奖。试回答下列问题:
2NH3(g);△H= -92.4kJ/mol他因此获得了1918年诺贝尔化学奖。试回答下列问题:
⑴合成氨工业中采取的下列措施可用勒夏特列原理解释的是 (填序号)
A、采用较高压强(20Mpa~50Mpa)
B、采用500℃的高温
C、用铁触媒作催化剂
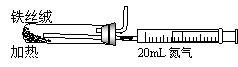 D、将生成的氨液化并及时从体系中分离出来,N2和H2循环到合成塔中并补充N2和H2
D、将生成的氨液化并及时从体系中分离出来,N2和H2循环到合成塔中并补充N2和H2
⑵右图是实验室模拟工业法合成氨的简易装置。
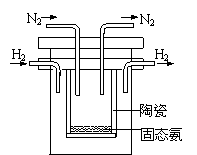 简述检验有氨气生成的方法
。
简述检验有氨气生成的方法
。
⑶在298K时,将10molN2和30molH2放入合成塔中,
为何放出的热量小于924kJ?
。
⑷1998年希腊亚里斯多德大学的Marmellos和Stoukides
采用高质子导电性的SCY陶瓷(能传递H+),实现了高温
常压下高转化率的电化学合成氨。其实验装置如图。
阴极的电极反应式 。
21.(12分)有机物A(C6H8O4)为食品包装纸的常用防腐剂。A可以使溴水褪色。A难溶于水,但在酸性条件下可发生水解反应,得到B(C4H4O4)和甲醇。通常状况下B为无色晶体,能与氢氧化钠溶液发生反应。
(1)A可以发生的反应有 (选填序号)。
① 加成反应 ② 酯化反应 ③ 加聚反应 ④ 氧化反应
(2)B分子所含官能团的名称是 、 。
(3)B分子中没有支链,其结构简式是 ,B的具有相同官能团的同分异构体的结构简式是 。
(4)由B制取A的化学方程式是: 。
(5)天门冬氨酸(C4H7NO4)是组成人体蛋白质的氨基酸之一,可由B通过以下反应制取:

天门冬氨酸的结构简式是 。
20.(10分)单质A在适宜条件下有如图所示的一系列转化,其中F是一种红褐色物质。试解答下列各题:
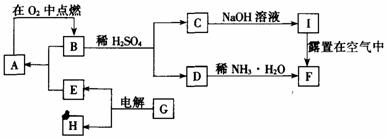
(1)写出下列物质的化学式:A ,B 。
(2)用化学方程式表示下列转化过程
B+H2SO4→C+D:________________ ___________。
I露置在空气中转化为F:_________________________ __。
(3)G可能是_________或_________;每生成1molE同时生成与其对应H的物质的量是________ mol或_________mol。
19.(8分)A、B、C、D、E 5瓶透明溶液,分别是HCl、BaCl2、NaHSO4、Na2CO3和AgNO3中的一种。已知:
①A与B反应有气体生成 ②B与C反应有沉淀生成
③C与D反应有沉淀生成 ④D与E反应有沉淀生成
⑤A与E反应有气体生成 ⑥在②和③的反应中生成的沉淀是同一种物质
请填空:
(1)在②和③的反应中,生成的沉淀物质的化学式(分子式)是 。
(2)A是 ,B是 ,C是 ,D是 ,E是 。
(3)A与E反应的离子方程式是 。
18.(14分)实验室用燃烧法测定某氨基酸(CxHyNzOp)的分子组成。取m g 该种氨基酸放在纯氧中充分燃烧,生成CO2、H2O和N2。按下图所示装置进行实验。
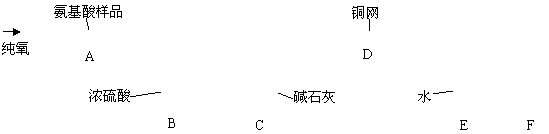
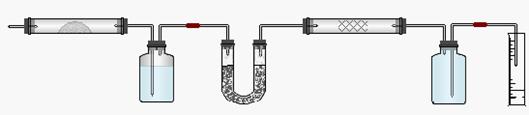
请回答下列问题:
(1)实验开始时,首先要通入一段时间的氧气,其理由是________________________。
(2)以上装置中需要加热的仪器有_________________(用字母填空,下同)。操作时应先点燃_______处的酒精灯。
(3)A装置中发生反应的化学方程式是_____________________________________。
(4)装置D的作用是_____________________________________________________。
(5)读取N2的体积时,应注意①__________ __;②________ ___。
(6)实验中测得N2的体积为V mL(标准状况)。为确定此氨基酸的化学式,还需要的有关数据是________________________。
17.(10分)间接碘量法测定胆矾中铜含量的原理和方法如下:
已知:在弱酸性条件下,胆矾中Cu2+与I-作用定量析出I2,I2溶于过量的KI溶液中:
I2+I-==I3-,又知氧化性:Fe3+>Cu2+>I2>FeF63-;析出I2可用cmol/LNa2S2O3标准溶液滴定:2S2O32-+I3-==S4O62-+3I-。
操作:准确称取ag胆矾试样(可能含少量 Fe2(SO4)3),置于250mL碘量瓶(带磨口塞的锥形瓶)中,加50mL蒸馏水、5mL3mol/LH2SO4溶液,加少量NaF,再加入足量的10%KI溶液,摇匀。盖上碘量瓶瓶盖,置于暗处5min,充分反应后,加入1~2mL0.5%的淀粉溶液,用Na2S2O3标准溶液滴定到蓝色褪去时,共用去VmL标准液。
①实验中,在加KI前需加入少量NaF,推测其作用可能是 。
②实验中加入硫酸,你认为硫酸的作用是 。
③本实验中用碘量瓶而不用普通锥形瓶是因为: 。
④硫酸铜溶液与碘化钾溶液反应生成白色沉淀(碘化亚铜)并析出碘,该反应的离子方程式为: 。
⑤根据本次实验结果,该胆矾试样中铜元素的质量分数ω(Cu)= 。
16.(4分)化学实验必须注意安全,下列做法存在安全隐患的是 (选填序号)
A、氢气还原氧化铜实验中,先加热氧化铜后通氢气
B、蒸馏石油时,加热一段时间后发现未加碎瓷片,立刻拔开橡皮塞并投入碎瓷片
C、实验室做钠的实验时,余下的钠屑投入到废液缸中
D、配制浓硫酸与酒精混合液时,将1体积的酒精倒入3体积的浓硫酸中
E、皮肤上沾有少量浓硝酸时,立刻用大量水冲洗,再涂上稀碳酸氢钠溶液
F、制乙烯时,用量程为300℃的温度计代替量程为200℃的温度计,测反应液的温度
15.在恒温恒容的密闭容器中,发生反应3A(g)+B(g)  xC(g)。
xC(g)。
Ⅰ、将3molA和2molB在一定条件下反应,达平衡时C的体积分数为a;
Ⅱ、若起始时A、B、C投入的物质的量分别为n(A)、n(B)、n(C),平衡时C的体积分数也为a。
下列说法正确的是 ( )
A.若Ⅰ达平衡时,A、B、C各增加1mol,则B的转化率将一定增大
B.若向Ⅰ平衡体系中再加入3molA和2molB,C的体积分数若大于a,可断定x>4
C.若x=2,则Ⅱ体系起始物质的量应当满足3 n(B) =n(A)+3
D.若Ⅱ体系起始物质的量当满足3 n(C) +8n(A)==12 n(B)时,可断定x=4
第Ⅱ卷(非选择题 共88分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com