
题目列表(包括答案和解析)
5.2005年11月13日中国石油吉林石化公司双苯厂发生爆炸事故,大量硝基苯泄漏,引起松花江水污染,安全生产和环保问题再次引起人们的关注。下列关于硝基苯的叙述正确的是…………………………………………………………………………………( )
A.硝基苯是一种油状物质,会浮在水面上 B.实验室制硝基苯需要用水浴加热
C.硝基苯中毒是由蒸气吸入或误食引起的,与皮肤接触不会引起中毒
D.硝基苯是由苯酚和硝酸直接反应生成的
4.下列关于原子的几种描述中,错误的是……………………………………………( )
A.18O与19F具有相同的中子数 B.16O与17O具有相同的电子数
C.12C与13C具有相同的质量数 D.15N与14N具有相同的质子数
3.下列各项中表达正确的是……………………………………………………………( )
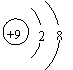

A.F-的结构示意图: B.乙炔的分子模型示意图:
C.NaCl的电子式: D.乙酸的结构简式:C2H4O2
D.乙酸的结构简式:C2H4O2
2.下列物质名称和括号内化学式对应的是………………………………………………( )
A.纯碱(NaOH) B.甲醛(CH3OH) C.胆矾(CuSO4·5H2O) D.生石灰(Ca(OH)2)
1.科学家指出,目前全球气候正在变暖,这主要是因为温室效应造成的。下列气体与地球温室效应密切相关的是………………………………………………………………( )
A.SO2 B.CO2 C.O3 D.NO2
26.(9分)根据烷烃、烯烃、炔烃燃烧的反应式,有人总结出如下规律:
对于烷烃有:n(烷烃)= n(H2O)- n(CO2);对于烯烃: n(H2O)- n(CO2)= 0;对于炔烃有:n(炔烃)= n(CO2)- n(H2O)。请回答下列问题:
(1)C2H6和C2H4混合气1.0L在氧气中充分燃烧生成2.0LCO2和2.4L水蒸气(相同状况),则混合气中C2H6和C2H4的体积是 (填序号)。
(A)3:1 (B)1:3 (C)2:3 (D)3:2
(2)某混合气体由烯烃和烷烃或烯烃和炔烃组成。组成中可能是两种气体,也可能是多种气体。将1.0体积混合气在氧气中充分燃烧,产生3.0体积水蒸气和3.7体积CO2(相同状况下测定)。
①判断混合气由 和 两类烃组成。
②上述判断的理由是 (简要文字)。
③上述两类烃的体积比为 。
|
|

|

 例如:2CH3COOK + 2H2O CH3CH3
+ 2CO2↑ + H2↑ + 2KOH
例如:2CH3COOK + 2H2O CH3CH3
+ 2CO2↑ + H2↑ + 2KOH
 根据下列演变关系:
根据下列演变关系:
(1)写出电极反应式
阳极 ;阴极 。
(2)写出下列反应的化学方程式:

 A B
; B C 。
A B
; B C 。
(3)D和B在不同条件下反应,会生成3种不同的E,其中属于高分子的E为
。
禅城区2006-2007学年度高三调研测试
25.(9分)某化学兴趣小组,专门研究了氧族元素及其某些化合物的部分性质。所查资料如下:
(1)碲(Te)为固体,H2Te为气体,Te和H2不能直接化合生成H2Te
 (2)等物质的量氧气、硫、硒、碲与H2反应的焓变
(2)等物质的量氧气、硫、硒、碲与H2反应的焓变
情况如图所示:
请回答下列问题:
(1)H2与硫化合的反应 热量(填“放
出”或“吸收”)。
(2)已知H2Te分解反应为熵增反应,请解释为什么Te和H2的反应不能自发发生 。
(3)在容积均为1 L(容器体积不可变)的甲、乙两个容器中,分别加入2 mol SO2、1 mol O2 和4 mol SO2、2 mol O2,在相同温度、催化剂下使其反应。最终达到平衡后,两容器中SO2转化率分别为α甲、α乙,甲容器中平衡常数表达式为
(用含α甲的代数式表示),此时α甲 α乙(填“大于”、“小于”或“等于”)。
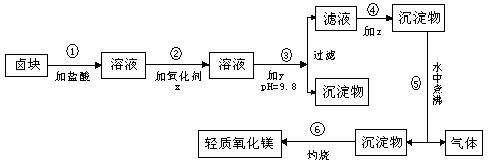
24.(13分)“卤块”的主要成分为MgCl2(含Fe3+、Fe2+、Mn2+等杂质离子),若以它为原料,按如下的工艺流程图,即可制得“轻质氧化镁”。
生成氢氧化物沉淀的pH 化学试剂价格表
|
物质 |
开始沉淀 |
沉淀完全 |
|
试剂 |
价格/元/吨 |
|
Fe(OH)3 |
2.7 |
3.7 |
漂液(含NaClO25.2%) |
450 |
|
|
Mn(OH)2 |
6.3 |
9.8 |
H2O2(30%) |
2400 |
|
|
Mg(OH)2 |
9.6 |
11.1 |
NaOH(固体,98%) |
2100 |
|
|
|
|
|
Na2CO3(固体99.5%) |
600 |
|
|
|
|
|
卤块(MgCl2,30%) |
310 |
如果要求产品尽量不含杂质,而且成本较低。请回答问题:
(1)在步骤②加入的氧化剂x,最佳选择应是 ,其作用是 。
(2)在步骤③加入的试剂y应是 ,之所以要控制pH=9.8,其目的
是 。
(3)步骤⑤⑥分别发生反应的化学方程式是 , 。
23. (9分)科学家从化肥厂生产的(NH4)2SO4中检出组成N4H4(SO4)2的物质,经测定,该物质易溶于水,在水中以SO42-和N4H44+两种离子形式存在,植物的根系极易吸收N4H44+,但它遇到碱时,会生成一种形似白磷的N4分子,N4分子不能被植物吸收。请回答下列问题:
⑴ N4和N2的关系正确的是___________(填序号);
A.同种单质 B.同位素 C.同分异构体 D.同素异形体
⑵ N4H4(SO4)2______ (填“能”或“不能”)和草木灰混合施用;
 ⑶
已知白磷、NH4+、N4H44+的空间构型均为四面体,NH4+的结构式为
⑶
已知白磷、NH4+、N4H44+的空间构型均为四面体,NH4+的结构式为
(→ ,表示共用电子对由N原子单方面提供),白磷(P4)的结构式

为 ,请画出N4H44+的结构式 。
⑷ 已知液氨中存在着平衡2NH3 NH4++NH2-。科学家在液氨中加入氢氧化铯(CsOH)和特殊的吸水剂,使液氨中的NH4+生成N4分子,请写出液氨与氢氧化铯反应的化学方程式:__________________________________________。
NH4++NH2-。科学家在液氨中加入氢氧化铯(CsOH)和特殊的吸水剂,使液氨中的NH4+生成N4分子,请写出液氨与氢氧化铯反应的化学方程式:__________________________________________。
22.(15分)某工业产品硫酸铁中含有少量的FeSO4杂质。现要测定其中铁元素质量分数,设计了如下实验步骤:
①称量ag样品,置于烧杯中;
②加入适量稀硫酸和适量蒸馏水,使样品溶解,然后配成250mL溶液;
③准确量取25.00mL操作②中配得的溶液,置于烧杯中,加入适量的溴水,加热使反应完全;
④趁热迅速加入过量氨水,充分搅拌,使沉淀完全;
⑤过滤,洗涤沉淀;
⑥将沉淀转移到蒸发皿内。加热、搅拌,直到固体全部由红褐色变为红棕色后,冷却至室温后,称量;
⑦······
根据以上实验设计,回答:
(1)溶解样品时加入稀硫酸的目的是 ;
(2)加入溴水后,发生反应的离子方程式是 ;
(3)加入氨水要过量的原因是 ;
(4)洗涤的目的是洗去附着在沉淀上的 ,在过滤器上洗涤沉淀的操作是 。
(5)第⑥步操作中,将沉淀物加热,冷却至室温,称量其质量为bg,再加热并冷却至室温称量其质量为cg,且b – c = 0.3,接下来的操作应当是 ;
(6)若蒸发皿的质量为w1,蒸发皿与加热后固体总质量是w2,则样品中铁元素的质量分数是 。(列出算式,不需化简)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com