
题目列表(包括答案和解析)
8.2005年10月12日我国成功发射了第二艘载人航天飞船--“神州六号”,实现了双人多天太空旅行。这标志着中国人的太空时代又前进了一大步。发射“神六”时用肼(N2H4)作为火箭发动机的燃料,NO2为氧化剂,反应生成N2和水蒸气。
已知:N2(g) + 2O2(g) = 2NO2(g); △H = + 67.7kJ/mol
N2H4(g) + O2(g) = N2(g) + 2H2O(g); △H = – 534kJ/mol
下列关于肼和NO2反应的热化学方程式中,正确的是
A.2N2H4(g) + 2NO2(g) = 3N2(g) + 4H2O(g); △H = – 1135.7kJ/mol
B.2N2H4(g) + 2NO2(g) = 3N2(g) + 4H2O(g); △H = – 1000.3kJ/mol
C.N2H4(g) + NO2(g) = 3/2N2(g) + 2H2O(l); △H = – 601.7kJ/mol
D.2N2H4(g) + 2NO2(g) = 3N2(g) + 4H2O(l); △H = – 1135.7kJ/mol
7.用NA表示阿伏加德罗常数,下列说法一定正确的是
A.足量钠与32g氧气完全反应转移的电子数为2NA
B.含1mol碳原子的碳单质中,C-C共价键数为1.5NA
C.在标准状况下,11.2LNO与N2混合气中含原子数为NA
D.pH=1的盐酸、硫酸混合溶液中,所含H+离子数为0.1NA
6.最近美国宇航局(NASA)马里诺娃博士找到了一种比二氧化碳有效104倍的“超级温室气体”-全氟丙烷(C3F8),并提出用其“温室化火星”使之成为第二个地球的计划。有关全氟丙烷的说法正确的是
A.分子中三个碳原子可能处于同一直线上
B.全氟丙烷在固态时晶体类型为原子晶体
C.相同压强的条件下,沸点:C3F8<C3H8
D.全氟丙烷分子中既有极性键又有非极性键
5.已知下列三组实验:①向KMnO4晶体滴加浓盐酸,产生黄绿色气体;②向FeCl2溶液中通入少量实验①产生的气体,溶液变黄色;③取实验②生成的溶液滴在淀粉KI试纸上,试纸变蓝色。下列判断正确的是
A.上述实验证明氧化性:MnO4->Cl2>Fe3+>I2
B.上述实验中,共发生了两个氧化还原反应
C.实验①生成的气体不能使湿润的淀粉KI试纸变蓝
D.实验②证明Fe2+既有氧化性又有还原性
4.实验是研究化学的基础,下图中所示的实验方法、装置或操作完全正确的是
A.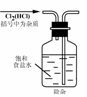 B.
B.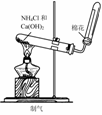
C.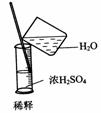 D.
D.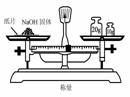
3.不具有放射性的同位素称之为稳定同位素,稳定同位素分析法在近20年来植物生理学、
生态学和环境科学研究中获得广泛应用。如在陆地生态系统研究中,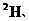
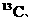
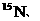
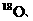
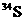 等常用作环境分析指示物。下列说法正确的是
等常用作环境分析指示物。下列说法正确的是
A.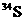 原子核内中子数为16
原子核内中子数为16
B.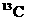 和
和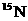 原子核内的质子数相差2
原子核内的质子数相差2
C.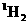
 在相同条件下比
在相同条件下比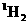
 更易蒸发
更易蒸发
D.相同条件下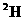 +的酸性比
+的酸性比 +的酸性更强
+的酸性更强
2.正确掌握化学用语是学好化学的基础。下列有关表述中正确的一组是
A.C2H4和C4H8两物质中碳的质量分数相同,它们一定是同系物
B.16O与18O互为同位素;H216O、D216O、H218O、D218O互为同素异形体
C.S2-的结构示意图为: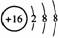 ,NH4Cl的电子式为:
,NH4Cl的电子式为: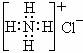
D.SiH4、CH4、NH4+的空间构型均为正四面体型;CO2、C2H2均为直线型
1.化学与科技、社会、生产密切相关。下列有关说法正确的是
A.“乙醇汽油”的广泛使用可以消除汽车尾气对环境的影响
B.“无磷洗涤剂”的推广使用,可以减少水体富营养化的发生
C.医疗上进行胃部造影前,患者服用的“钡餐”是碳酸钡等难溶性物质
D.铝合金的大量使用归功于人们能用焦炭等还原剂从氧化铝中获取铝
25.(10分) 在t℃时,向盛有500 g水的烧杯中加入3.7 g Ca(OH)2粉末,充分搅拌。已知t℃时,Ca(OH)2的溶解度是0.185 g。并假设在溶解和反应过程中溶液的体积温度基本保持不变,所得溶液的密度约为1.00g/cm3。试计算下列问题(计算结果保留2位小数)。
(1)求烧杯中所得的石灰水中OH-离子的物质的量浓度。
(2)若采用向上述烧杯中通入CO2气体的方法,使溶液中的Ca2+离子浓度等于0.01 mol·L-1,则需要向烧杯中通入标准状况下CO2 的体积是多少?
海门市2006--2007学年第一学期高三第一次诊断考试
24.(8分) 能源是人类社会发展进步的物质基础。在当代,能源同信息、材料一起构成了现代文明的三大支柱。
(1)为了降低汽车尾气对大气的污染,江苏有关部门拟用甲醇替代液化石油气作为公交车的燃料。已知:在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ。请写出表示甲醇燃烧热的热化学方程式。
(2)测定工业甲醇中CH3OH的质量分数可按下法:取0.1000g工业甲醇样品,以适量H2SO4酸化后,加入20.00mL 0.2000mol/L的K2Cr2O7溶液,再用0.3000mol/L (NH4)2Fe(SO4)2标准溶液滴定,耗去此标准液20.00mL时,刚好到达滴定终点。
已知:CH3OH+Cr2O72-+8H+=CO2↑+2Cr3++6H2O
①写出H2SO4酸化的K2Cr2O7溶液与(NH4)2Fe(SO4)2溶液反应的离子方程式。
②求此工业甲醇中CH3OH的质量分数。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com