
题目列表(包括答案和解析)
13.下图为一种氢氧燃料电池的示意图。关于该氢氧燃料电池的说法中正确的是

A.a电极上发生的电极反应式为O2+4H++4e-=2H2O
B.b电极上发生的电极反应为还原反应
C.外电路中电子从b电极流向a电极
D.电池工作时电池内部的电解质溶液pH不变
12.X、Y、Z、W均为短周期元素且核电荷数依次增加,X的最外层电子数是内层电子总数的3倍,Y原子最外层只有一个电子,Z与X的核电荷数之比为3∶2,W原子的最外层电子数比次外层电子总数少1。有关下列叙述正确的是
A.最高价氧化物对应的水合物的碱性:YOH>Z(OH)2
B.气态氢化物的稳定性:HX>H2W
C.X、Y两元素形成的离子化合物中阴、阳离子个数比可能为1∶2
D.X、W两元素形成的化合物中X通常为负价
11.如下图所示的转化关系中,每个字母代表一种物质。其中B是常见的金属单质,X、Y是常见的非金属单质,其余均为由两种元素组成的常见化合物(每步转化中无关生成物没有列出)。
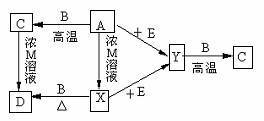
当X为黄绿色气体、Y为无色气体时,下列各种推断合理的是:
① 组成B的元素处于元素周期表中的第三周期第IIA族;② C是一种熔点很高的物质;③ D的水溶液显酸性;④ E是一种液体,且分子中两种组成元素的原子个数比为1∶1;⑤ 在X+E→Y的反应中,X的氧化性大于Y。
A.①③⑤ B.②④ C.④⑤ D.②③④⑤
10.一定温度下,在固定容积、体积为2L的密闭容器中充入1molN2和3molH2发生反应,当反应进行到10s末时达到平衡,此时容器中c(NH3)=0.15mol·L-1。下列有关判断不正确的是
A.反应达平衡时N2的转化率为7.5%
B.反应进行到10s末时,H2的平均反应速率是0.0225mol·(L·s)-1
C.该反应达到平衡时的标志是容器中气体密度不再改变
D.该反应达到平衡时的标志是容器中气体压强不再改变
9.下列离子方程式书写正确的是
A.Ba(OH)2溶液和(NH4)2SO4溶液混合:Ba2++ =BaSO4↓
=BaSO4↓

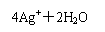
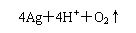 B.碳酸氢钙溶液与少量的石灰水反应:Ca2++
B.碳酸氢钙溶液与少量的石灰水反应:Ca2++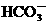 +OH-=CaCO3↓+H2O
+OH-=CaCO3↓+H2O
C.用惰性电极电解AgNO3溶液:
D.Na2O2粉末加入水中:2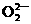 +2H2O=4OH-+O2↑
+2H2O=4OH-+O2↑
8.2.8gFe全部溶于一定浓度、100mL的HNO3溶液中,得到标准状况下的气体1.12L,测得反应后溶液的pH为1。若反应前后溶液体积变化忽略不计,则下列有关判断不正确的是
A.反应前HNO3溶液的浓度为2.0mol·L-1 B.1.12L的气体全部为NO
C.反应后溶液中c(NO3-)=1.6mol·L-1 D.反应后的溶液最多还能溶解1.61gFe
7.下列各项因果关系中正确的是
A.金刚石的熔点高于晶体硅,因为两种晶体中原子间平均距离前者小于后者
B.水的热稳定性比较高,因为水分子之间存在氢键
C.金属晶体能导电,因为金属晶体中存在金属阳离子
D.离子晶体硬度较大、难于压缩,因为离子晶体中的阴、阳离子排列很有规则
6.能证明CH3COOH为弱电解质的实验是
① 分别测定浓度均为0.1mol·L-1的HCl溶液和CH3COOH溶液的pH;② 分别向浓度均为1mol·L-1的HCl溶液和CH3COOH溶液中投入大小外观基本相同的Zn粒;③ 测定一定浓度的CH3COONa溶液的pH;④ 将1.0mol·L-1的HCl溶液和1.0mol·L-1的CH3COOH溶液分别稀释100倍,并分别测定两种溶液稀释前后的pH;⑤ 将等浓度盐酸和醋酸分别滴加到等浓度的Na2CO3溶液中。
A.除⑤外均可以 B.只有①和③ C.全部 D.只有②和⑤
5.下列各种情况下一定不能大量共存的离子组是
A.能与Al反应放出H2的溶液中:Na+、K+、CO32-、SO42-
B.0.1mol·L-1NaOH溶液中:NH4+、NO3-、Br-、HCO3-
C.能与Na2CO3反应放出CO2的溶液中:H+、Mg2+、Ba2+、I-
D.pH为1的紫色溶液中:K+、Fe2+、Cl-、MnO4-
4.设NA为阿伏加德罗常数,下列有关说法正确的是
A.标准状况下,22.4LSO3中含有的氧原子数为3NA
B.铜的电解精炼时,当阴极析出32gCu时,阳极产生的Cu2+离子数为0.5NA
C.将5.0mol·L-1的FeCl3溶液20mL滴加到沸水中形成的胶体中,分散质粒子数为0.1NA
D.26.75gNH4Cl中含有的共用电子对数为2NA
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com