
题目列表(包括答案和解析)
3.研究结构应分三层次考虑.
(1)原子结构(价电子数、原子半径、核电荷数等)
(2)分子结构(主要指化学键的种类及牢固程度)
(3)晶体结构(构成微粒、微粒间的作用力、空间构型等)
2.注意该族元素与其代表物在结构、性质上的相似性、递变性和特殊性.
1.每族元素抓住代表物.重点讨论该元素的单质、氧化物、氢化物、酸、碱或盐等有关知识.
14.有点难度哟!
(12分)一包重41.6 g的固体样品,其成分是硫和铁的化合物,将它充分煅烧后,硫和铁分别被氧化成SO2和Fe2O3,其中SO2在标准状况下为13.44 L。试求:
(1)样品中硫元素与铁元素的物质的量之比。
(2)样品化合物的成分是什么?
(3)样品中化合物的物质的量为多少?
解析:(1)n(SO2)=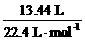 =0.6 mol,41.6 g样品中含铁的质量为m(Fe)= 41.6 g-0.6
mol×32 g·mol-1=22.4 g,n(Fe)=
=0.6 mol,41.6 g样品中含铁的质量为m(Fe)= 41.6 g-0.6
mol×32 g·mol-1=22.4 g,n(Fe)=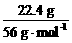 =0.4 mol,n(S)∶n(Fe)=0.6
mol∶0.4 mol=3∶2。
=0.4 mol,n(S)∶n(Fe)=0.6
mol∶0.4 mol=3∶2。
(2)因1∶1<3∶2<2∶1,故该样品为FeS和FeS2的混合物。
(3)设FeS、FeS2的物质的量分别为x、y,则有

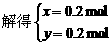
答案:(1)3∶2(3分)
(2)FeS和FeS2(3分)
(3)FeS为0.2 mol(3分),FeS2为0.2 mol(3分)
13.(9分)一氧化氮是大气污染物之一。目前,有一种治理的方法是在400 ℃左右,在催化剂存在的情况下,用氨把一氧化氮还原为氮气和水,请写出该反应的化学方程式:_____________________________________。有人设想用天然气替代NH3处理NO,①如能,请写出相关的化学方程式:____________________________________,并指出采用这一方案的优点:____________________;②如不能,请说明原因:_____________________。
解析:用化合价升降法配平NH3与NO反应的化学方程式: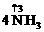 +
+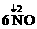
 5N2+
5N2+
6H2O。天然气的主要成分是CH4,CH4的还原性强于NH3,则CH4可与NO发生如下反应:4NO+CH4====CO2+2N2+2H2O,本方案的优点是相同质量的CH4和NH3还原NO,CH4还原的NO多且天然气资源丰富,可使生产成本降低。
答案:4NH3+6NO 5N2+6H2O(3分) CH4+4NO
5N2+6H2O(3分) CH4+4NO 2N2+CO2+2H2O(3分) 相同质量的CH4和NH3还原NO,CH4还原的NO多且天然气资源丰富,大大降低了生产成本(3分)
2N2+CO2+2H2O(3分) 相同质量的CH4和NH3还原NO,CH4还原的NO多且天然气资源丰富,大大降低了生产成本(3分)
12.(13分)有a、b、c三种常见的短周期元素,它们之间两两结合构成化合物X、Y、Z,X、Y、Z之间也能相互发生反应。已知X是由a和b元素按原子个数比1∶1组成的化合物,a、b、c元素形成的单质(仍用a、b、c表示)和由它们组成的化合物之间的反应关系如下(未配平):
①b+c Y ②a+c
Y ②a+c Z ③X+Y
Z ③X+Y m ④X+Z
m ④X+Z c+n ⑤Y+Z
c+n ⑤Y+Z c+n
c+n
(1)上述反应中,有最充分理由说明该反应一定属于氧化还原反应的是_________(填反应编号)。
(2)如果m是一种无色黏稠油状液体化合物,则X、Y、Z的化学式分别是_________、_________、_________。
(3)③反应的化学方程式是_______________。
(4)④反应的化学方程式是_______________。
解析:本题考查了氧化还原反应与基本反应类型的关系及物质的推断。作为推断题,找到“题眼”或“突破口”非常关键。本题对m的推测是解题的突破口,利用假设论证法可顺利解出此题。根据题干信息,m是无色黏稠油状液体化合物,可假设它是浓H2SO4,再进一步论证。按题给信息倒推:X、Y为SO3和H2O。但这与题中所述X中a∶b=1∶1相矛盾。假想X为H2O,则Y为SO2。H2O2有氧化性,SO2有还原性,两者反应生成H2SO4也是合理的。
由此可得的:a为H,b为O,c为S。
由b+c Y得O2+S
Y得O2+S SO2 Y为SO2
SO2 Y为SO2
由a+c Z得H2+S
Z得H2+S H2S Z为H2S
H2S Z为H2S
由X+Y m得H2O2+SO2
m得H2O2+SO2 H2SO4
H2SO4
由X+Z c+n得H2O2+H2S
c+n得H2O2+H2S S+H2O
S+H2O
由Y+Z c+n得SO2+H2S
c+n得SO2+H2S S↓+H2O
S↓+H2O
有单质参加的化合或分解反应肯定为氧化还原反应,可推知①②④⑤是氧化还原反应。
答案:(1)①②④⑤(3分)
(2)H2O2 SO2 H2S(各2分)
(3)H2O2+SO2====H2SO4(2分)
(4)SO2+2H2S====3S↓+2H2O(2分)
11.(11分)如图所示:
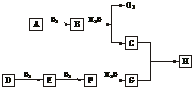
在上述转化关系中,已知B、D都是淡黄色固体,且A与D可反应生成离子化合物。回答:
(1)写出下列物质的化学式A._______,F._______,H._______。
(2)写出C的电子式_______。
(3)写出B C、E
C、E F的化学方程式。
F的化学方程式。
解析:常见的淡黄色固体有S、Na2O2、AgBr等,由B与水反应产生O2可知B为Na2O2,C为NaOH。D与O2反应生成E,E与O2继续反应生成F,且D与A生成离子化合物可知,D为S,E为SO2,F为SO3,G为H2SO4,H为Na2SO4。
答案:(1)Na(1分) SO3(1分) Na2SO4(1分) (2)Na+[∶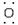 ∶H]-(2分)
∶H]-(2分)
(3)2Na2O2+2H2O====4NaOH+O2↑(3分)
2SO2+O2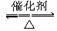 2SO3(3分)
2SO3(3分)
10.(10分)我国劳动人民早在4000多年前就已用一种朱红色的颜料W,请根据下列实验事实确定组成W的两种元素,并填空:

(1)W的组成元素是_______、_______。
(2)A C的化学方程式_______________。
C的化学方程式_______________。
(3)使用朱红颜料W不慎会使人中毒的原因是_________________。
解析:在C溶液中加BaCl2与HCl溶液得白色沉淀E,知C中含有SO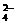 ,故A气体为SO2;又银白色物质B可溶于HNO3,且所得溶液与Cu作用又得B,故B为Hg。所以W的组成元素为Hg、S。由于HgS为重金属盐,可使蛋白质变性,故会使人中毒。
,故A气体为SO2;又银白色物质B可溶于HNO3,且所得溶液与Cu作用又得B,故B为Hg。所以W的组成元素为Hg、S。由于HgS为重金属盐,可使蛋白质变性,故会使人中毒。
答案:(1)Hg(2分) S(2分)
(2)Br2+SO2+2H2O====H2SO4+2HBr(3分)
(3)HgS为重金属盐,能使蛋白质(凝聚)变性(3分)
9.(2005年威海模拟题)清晨,松树林中的空气格外清新,是因为有极少量的氧气能够变成臭氧(O3),反应的化学方程式为:3O2====2O3。下列有关说法正确的是
A.这是一个化合反应
B.产生的臭氧可以填充“臭氧空洞”
C.这是一个氧化还原反应
D.产生的臭氧与氧气是氧的同素异形体
解析:由同种元素形成的不同单质互称同素异形体。此反应为同素异形体间的相互转换,反应类型既不是化合也不是氧化还原反应,且无论从O3的生成量或在大气中的位置看,都不涉及“臭氧空洞”。
答案:D
8.(2005年全国名校联考模拟题)我国三峡工程所提供的清洁、廉价、强劲、可再生的水电,相当于每年燃烧3000万吨原煤的火力发电厂产生的电能,因此,三峡工程有助于控制
①温室效应 ②二氧化硫的排放 ③白色污染 ④碳氢化合物的排放
A.①② B.①②③ C.①②④ D.①②③④
解析:煤燃烧会产生大量的CO2和SO2气体,用水代煤发电可控制CO2和SO2的排放。
答案:A
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com