
题目列表(包括答案和解析)
6.有一金属钠与过氧化钠的混合物,与过量水充分反应后,产生的气体,用电火花引燃后,恢复到标准状况,测得剩余气体体积为1.12L,则原混合物中钠与过氧化钠的物质的量之比不可能的是( )
A.1:3 B.3:1 C.2:1 D.1:2
5.下列物质中,导电性能最差的是( )
A.石墨 B.KCl溶液 C.石英砂 D.熔化的NaHSO4
4.将水加入到下列物质中能发生反应,且有气体产生的是( )
①NaH ②Na2O2 ③Na2S ④Mg3N2 ⑤Al2S3 ⑥CaC2
⑦NH4HCO3
A.①②⑤⑥⑦ B.①②④⑤⑥ C.①③④⑤ D.①②⑤⑥
3.等质量的下列物质①C2H2 ②H2 ③Na ④P充分燃烧,消耗O2的质量由多到少的顺序为( )
A.①②③④ B.④③②① C.②①④③ D.①④②③
2.在密闭容器中盛有H2、O2、Cl2的混合气体,通过电火花点燃,三种气体正好完全反应,冷却至室温后,所得溶液溶质的质量分数为25.26%,则容器中原有H2、O2、Cl2的分子个数比是( )
A.6:3:1 B.9:6:1 C.13:6:1 D.10:6:1
1.微量硒元素(Se)对人体有保健作用.已知硒和氧同主族,与钾同周期,下列有关硒元素的性质描述错误的是( )
A.硒既能溶于盐酸又能溶于烧碱溶液
B.硒的最高价氧化物的化学式为SeO3
C.硒的非金属性比溴弱
D.硒的气态氢化物的化学式为H2Se
0.125(1-α)+0.0625α=0.1125
α=20%
(2)同理可得

注意:因原固体CuO部分分解,且最后固体成分有两种,故x的取值范围只能是开区间.
针对性练习
0.125(1-α) 0.125(1-α) 0.0625α 0.0625α
2.水
(1)水参与的反应
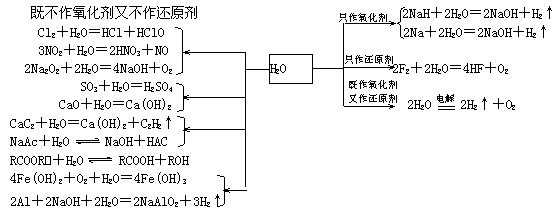
(2)水处理
①除去悬浮物:用明矾或FeCl3.
②脱色去味:用活性炭.
③杀菌消毒:用液氯、漂白粉、CuSO4.
④硬水软化:煮沸法、药剂法、离子交换法
想一想:每种方法的原理是什么?分属何种变化?
例1 1mol H2燃烧时约放热286KJ,而每kg汽油燃烧时约放热46000KJ.而氢气却被公认是21世纪替代石化燃料的理想能源.请试述理由.
解析 ①燃料发热量的高低要看单位质量的物质放热量的多少.
H2 - Q 汽油 - Q
2g 286KJ 1000g 46000KJ
1g 143KJ 1g 46KJ
由此可知:每g H2、汽油燃烧发热量前者大
②燃料是否理想,还要看来源是否丰富、燃烧对大气和环境保护是否有利.
氢气作为未来理想能源有三大优点:
①单位质量的H2燃烧发热量大.
②资源丰富.
③燃烧后不产生污染.
思考 Si、Al均能与强碱溶液反应放出H2.野外考察工作有时需要H2,为何一般选择Si而不用Al?
提示 从单位质量的Si、Al分别与碱液反应放出H2量的多少考虑.
例2 将含O2和CH4的混合气体充入装有23.4g Na2O2的密闭容器中点燃,反应结束后,容器温度为150℃,压强为Opa.将残留物溶于水无气体逸出.下列叙述正确的是( )
A.原混合气体中O2和CH4的体积比为2:1
B.原混合气体中O2和CH4的体积比为1:2
C.残留固体中有Na2CO3和NaOH
D.残留固体中只有Na2CO3
解析 若CH4与O2体积为1:2,则恰好反应,当气体产物通过Na2O2后必有O2生成,不合题意.
又根据氢、碳元素守恒,反应后的固体必为Na2CO3和NaOH的混合物.
由题意可知,最终反应后无Na2O2多余,也无气体多余.可用方程式的代数处理来求出CH4和O2的体积比.
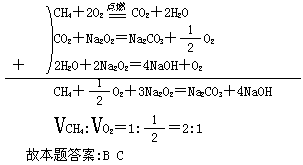
例3 已知氧化铜在高温下可发生分解
4CuO 2Cu2O+O2,
2Cu2O+O2,
生成的Cu2O也能被H2还原为Cu.
(1)若将10g CuO在高温下部分分解后,再通入氢气使剩余固体全部还原成铜,消耗0.225g H2,则原氧化铜的分解率是多少?
(2)若将mg CuO在高温下部分分解后,再通入ng H2,即可使剩余固体全部还原成铜,则原氧化铜的分解率是多少?n的取值范围是多少?
(3)仍取mg CuO.并保持(2)的分解率不变,假设通入H2后固体被还原是按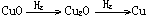 的顺序进行的,以x表示通入H2的质量(单位:g),试填写下表
的顺序进行的,以x表示通入H2的质量(单位:g),试填写下表
|
还原后剩余固体成分 |
CuO和Cu2O |
Cu2O和Cu |
|
x的取值范围 |
|
|
解析 (1)设CuO的分解率为α
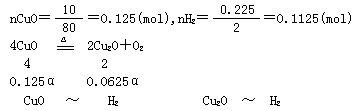
1.氢气:常温不很活泼,大多需高温(点燃)或用催化剂.高温下,作很好的还原剂.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com