
题目列表(包括答案和解析)
8. 室温时,在容积为90mL的大试管里充满NO2气体,然后倒置在水里,至试管内液面不在上升时,再通入一定量O2,则试管内液面继续上升,最后试管内留有10mL气体。问:(1)这10mL可能是什么气体?(2)通入O2的体积为多少? 9. 为了配制一种需含NaH2PO4和Na2HPO4(它们的物质的量之比为3:1)的培养液,已知每升混合液中含磷元素0.10摩尔。现在用4.0摩尔/升的磷酸溶液和固体NaOH反应来配制2.0升混合液,求需该磷酸溶液多少毫升和NaOH多少克? 10. 某试剂厂用银(含杂质铜)和硝酸(含杂质Fe3+反应制取硝酸银.步骤如下:
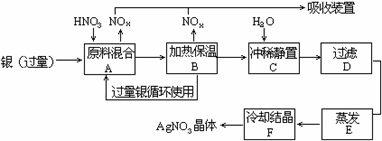
依据上述步骤,完成下列填空:
(1)(1)溶解银的硝酸应该用 硝酸(填浓或稀),原因是 。
(a)减少过程中产生NOx 的量 (b) 减少原料银的消耗量 (c)节省硝酸物质的量
(2)(2)步骤B加热保温的作用是 .
(a)有利于加快反应速度 (b)有利于未反应的硝酸挥发 (c)有利于硝酸充分反应,降低溶液中c(H+)
(3)(3)步骤C是为了除去Fe3+、Cu2+ 等杂质.冲稀静置时发生的化学反应是 (选类型),产生的沉淀物化学式 。
(a)置换反应 (b)水解反应 (c)氧化-还原反应
7. 分别将等质量的铜片与等体积均过量的浓硝酸、稀硝酸反应,所得到的溶液前者成绿色,后者呈蓝色,某同学提出这可能是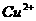 浓度差异引起的,你同意这种看法吗?__________(填“同意”或“不同意”),原因是________________________;另一同学提出溶液呈“绿色”是
浓度差异引起的,你同意这种看法吗?__________(填“同意”或“不同意”),原因是________________________;另一同学提出溶液呈“绿色”是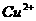 与
与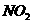 混合的结果,请你设计一个实验证明之(简述实验方案和实现现象)_____________________________________________________________。
混合的结果,请你设计一个实验证明之(简述实验方案和实现现象)_____________________________________________________________。
6. 某学生课外活动小组利用右图所示装置分别做如下实验:
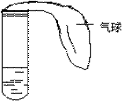 ⑴在试管中注入某红色溶液,加热试管,溶液颜色逐渐变浅,冷却后恢
复红色,则原溶液可能是________________溶液;加热时溶液由红色逐渐变浅的原因是:________ _______
_______________。
⑴在试管中注入某红色溶液,加热试管,溶液颜色逐渐变浅,冷却后恢
复红色,则原溶液可能是________________溶液;加热时溶液由红色逐渐变浅的原因是:________ _______
_______________。
⑵在试管中注入某无色溶液,加热试管,溶液变为红色,冷却后恢复
无色,则此溶液可能是________________溶液;加热时溶液由无色变
为红色的原因是: ____________________________________。
5. 在盛稀硫酸的试管中,加入一小块铜片后,观察不到明显的现象。然后再加入适量硝酸钾晶体并微热,可观察到的现象是① ,② ,③ 。写出反应的离子方程式 。
4. 把3体积NO2气体依次通过装有足量NaHCO3饱和溶液、浓H2SO4和Na2O2的三个装置,最后用排水法收集,假设氮的氧化物不与Na2O2反应,最后收集到 体积的气体,该气体的组成为 。
3. A、B两种气体组成的混合气体(相对分子质量A大于B),只含氮氢两种元素。不论A、B以何种比例混合,混合气体中氮氢两种元素的质量比始终大于14∶3,则A为 ,B为 (填化学式)。若混合气体中氮氢两元素的质量之比为14∶1,则混合气体中A、B的物质的量之比为 。
2.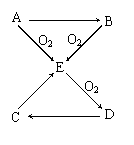 已知A、B、C、D、E五种物质有如图所示的转化关系(部分反应物及反应条件未列出,若解题时需要,可作合理假设),且五种物质中均含有A元素。
已知A、B、C、D、E五种物质有如图所示的转化关系(部分反应物及反应条件未列出,若解题时需要,可作合理假设),且五种物质中均含有A元素。
(1)若A为固体单质,则①D的分子式为 ,
② C→E的化学方程式为
③ 将E通入某些单质的溶液中,可发生反应生成两种强酸,试举一例写出化学方程式 。
(2)若A为气体单质,则
① D→C的化学方程式
② C→E的离子方程式为 。
1.将23.9g表面已锈蚀成铜绿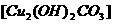 的铜片投入120mL一定浓度的硝酸中,充分反应后,硝酸被还原成
的铜片投入120mL一定浓度的硝酸中,充分反应后,硝酸被还原成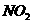 和NO,反应后溶液中
和NO,反应后溶液中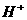 为0.160mol。往反应后的溶液中加入过量的NaOH溶液,滤出沉淀,洗涤、干燥后得到29.4g蓝色固体。求:
为0.160mol。往反应后的溶液中加入过量的NaOH溶液,滤出沉淀,洗涤、干燥后得到29.4g蓝色固体。求:
(1)铜片中单质铜的质量分数;
(2)铜片与硝酸充分反应后,溶液中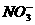 的物质的量浓度(假设反应前溶液的体积不变)。
的物质的量浓度(假设反应前溶液的体积不变)。
电化学的内容是历年高考命题的重点内容之一,出题形式丰富,其考查方式举例如下:
⑴ 电解原理的基础知识:包括电极名称或电解产物的确定、根据电极变化判断金属活泼性强弱或电极材料、电极反应式的书写或属性等。
例1 (2002年河南)在原电池和电解池的电极上所发生的反应,同属氧化反应或同属还原反应的是( )
A、原电池正极和电解池阳极所发生的反应 B、原电池正极和电解池阴极所发生的反应 C、原电池负极和电解池阳极所发生的反应 D、原电池负极和电解池阴极所发生的反应
分析:原电池负极和电解池阳极发生的是氧化反应;原电池正极和电解池阴极发生的是还原反应。故答案为B、C。
⑵ 有关电解的计算:通常是求电解后某产物的质量、物质的量、气体的体积、某元素的化合价以及溶液的pH、物质的量浓度等。运用电子守恒原理解答较好。
例2 (2002年春季)通以相等的电量,分别电解等浓度的硝酸银和硝酸亚汞(亚汞的化合价为+1价)溶液,若被还原的硝酸银和硝酸亚汞的物质的量之比n(硝酸银)︰n(硝酸亚汞)=2︰1,则下列表述正确的是( )
A、在两个阴极上得到的银和汞的物质的量之比n(Ag)︰n(Hg)=2︰1
B、在两个阳极上得到的产物的物质的量不相等
C、硝酸亚汞的分子式为HgNO3 D、硝酸亚汞的分子式为Hg2(NO3)2
分析:通以相等的电量即是通过相同的电子数,银和亚汞都是+1价,因此,得到的单质银和汞的物质的量也应相等;又因电解的n(硝酸银)︰n(硝酸亚汞)=2︰1,硝酸银的化学式为AgNO3,故硝酸亚汞的化学式不可能为HgNO3,只能为Hg2(NO3)2。所以,正确选项为D。
 ⑶ 联系生产生活:主要是新技术、新情景等问题的处理。
⑶ 联系生产生活:主要是新技术、新情景等问题的处理。
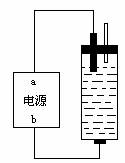
例3 (2002年上海)某学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和氯化钠溶液,通电时,为使Cl2被完全吸收,制得有较强杀菌能力的消毒液,设计了如图的装置,则对电源电极名称和消毒液的主要成分判断正确的是( )
A、a为正极,b为负极;NaClO和NaCl B、a为负极,b为正极;NaClO和NaCl
C、a为阳极,b为阴极;HClO和NaCl D、a为阴极,b为阳极;HClO和NaCl
 分析:
用石墨作电极电解饱和氯化钠溶液发生的反应是:2NaCl+2H2O
2NaOH+H2↑+Cl2↑,副反应为:2NaOH+Cl2=NaCl+NaClO+H2O,则可推知使Cl2被完全吸收制得有较强杀菌能力的消毒液的主要成分是NaClO和NaCl溶液,其中起消毒作用的是NaClO溶液。电解过程中阴极产生H2,结合图示,消毒液发生器的液体上部空间充满的是H2,故电源a极是负极,b为正极。所以答案为B。
分析:
用石墨作电极电解饱和氯化钠溶液发生的反应是:2NaCl+2H2O
2NaOH+H2↑+Cl2↑,副反应为:2NaOH+Cl2=NaCl+NaClO+H2O,则可推知使Cl2被完全吸收制得有较强杀菌能力的消毒液的主要成分是NaClO和NaCl溶液,其中起消毒作用的是NaClO溶液。电解过程中阴极产生H2,结合图示,消毒液发生器的液体上部空间充满的是H2,故电源a极是负极,b为正极。所以答案为B。
⑷ 综合应用:与物理学中的电路分析、电流强度、电阻、能量转化等联系渗透,也可以与环境保护、高新技术(如航天飞船)等综合测试。命题的灵活性大,学生思维空间的自由度也较大,正符合“3+X”考试精神。
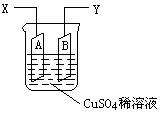 例4 (2003年春季)如图是可用于测量阿伏加德罗常数的装置示意图,其中A、B是两块纯铜片,插在CuSO4稀溶液中,铜片与引出导线相连,引出端分别为X、Y。
例4 (2003年春季)如图是可用于测量阿伏加德罗常数的装置示意图,其中A、B是两块纯铜片,插在CuSO4稀溶液中,铜片与引出导线相连,引出端分别为X、Y。
⑴ 当以I=0.21A的电流电解60min后,测得铜片A的质量增加了0.25g,则图装置中的X端应与直流电的 极相连,它是电解池的 极。
⑵ 电解后铜片B的质量 (答“增加”、“减少”或“不变”)。
⑶ 列式计算实验测得的阿伏加德罗常数NA。(已知电子电量e=1.60×10–19C)
分析:⑴因为铜片A的质量增加,A为电解池的阴极,电极反应式为:Cu2++2e–=Cu,X端应与直流电的负极相连接。⑵铜片B则为电解池的阳极,电极反应式为:Cu-2e–=Cu2+,其质量减少。⑶NA=64g·mol–1×0.21C·s–1×60min×60s·min–1/(0.25g×2×1.60×10–19C)=6.0×1023mol–1。
本单元可以归纳的知识还是比较多的。如用惰性电极电解酸、碱、盐溶液,就可以分为电解水型(例NaOH)、分解电解质型(例CuCl2)、放H2生碱型(例NaCl)、放O2生酸型(例CuSO4)等。又如电极名称与电极反应的关系可以用四个字概括:阳----氧,阴----还;实际上只须记“阳氧”两个字就可以了,其它的可以推理。再如电解的计算是本单元的一个重点应用问题,其常用的解题方法可以归结为两种:一是根据电解方程式或电极反应式列比例求解;二是利用各电极、线路中转移的电子数目守恒列等式求解(此法较为简便)。心理学上讲,将须记忆的东西浓缩的越多,提炼的越精简,就越容易记住。所以,学习中一定要注意将知识进行归纳、总结。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com