
题目列表(包括答案和解析)
22、(8分)在一定条件下(不允许添加别的反应物),经不同的化学反应,可实现如下图所示的各种变化,图中每个方框(除注明的溶液外)仅表示一种单质或一种化合物。
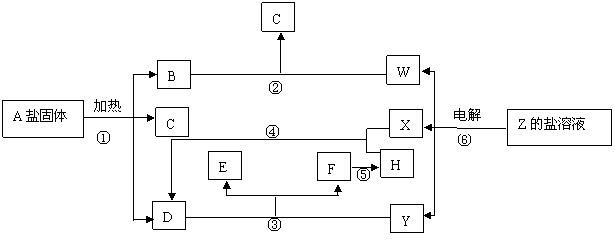
其中,反应③、④、⑤、⑥属氧化还原反应,而反应①、②属非氧化还原反应,X、H和Y和单质,且H是空气的主要成分之一,其余为化合物。A、Z的焰色反应(透过蓝色的钴玻璃)均显紫色。据此请填空:
(1)写出下列物质的化学式:A_____________,Z_____________,H_____________,C___________
(2)B物质形成的晶体类型为_______________,晶体中每个B周围紧邻的B有_______________个。
(3)写出反应②的化学方程式_______(4)写出反应③的化学方程式_______________
21、(12分)因生产过程中一些金属微粒混入部分锂电池,存在导致笔记本电脑冒烟、起火隐患,日本索尼公司2006年9月29日发布公告,要求紧急召回有缺陷的锂电池组。
Ⅰ由于锂电池的比容量(单位质量电极材料所能转换的电量)特别大,而广泛应用于心脏起搏器、手机、笔记本电脑。它的负极用金属锂制成,电池总反应可表示为:Li+MnO2=LiMnO2。锂电池比容量特别大的原因是_______________;该电池中的电解质溶液非水溶剂配制,为什么这种电池不能使用由水配制的电解质溶液,请用化学方程式表示其原因________
Ⅱ现将一块锂电池连入下图所示的电路乙装置用离子交换膜分隔成A、B两室。
(1) 写出甲装置中的两电极的电极反应式,锌极_______________铁极_______________。
甲装置能否用于在铁的表面镀铜__________
(选填“能”或“不能”,如果 “不能”请写出改进的方法。如果“能”,此问不必回答)_______________
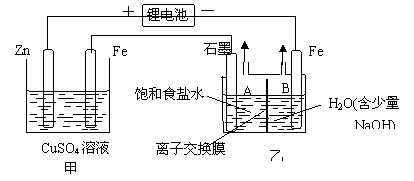
(2) 乙装置中离子交换膜的作用___。如果锂电池中转移了0.5mol电子,则A室析出________L(标准状况下)_________(填物质名称)气体。
(3)由于一些金属微粒混入锂电池,工作一段时间后,由于过热导致电池内部短路,此时乙装置中的现象是_______________,其原因是_______________。
20、(9分)纯碱是一种重要的化工原料,很多工业都需要用到纯碱。
|
的缺点是__________________。第二步中反应为:①Na2SO4+2C ==== Na2S+2CO2↑、
|
②Na2S+CaCO3 ======Na2CO3+CaS,其中属于氧化还原反应的为 _______________,该反应中氧化剂为_______________。


(提取副产品)
(2)19世纪中叶比利索尔维发明了氨碱法制纯碱,但存在原料利用率不高和副产品多的缺点。我国化学家侯德榜(如图)改革了此生产工艺,生产流程简要表示如上:
上述生产流程中原料氯化钠的利用率从70%提高到90%以上,主要是设计了_______________(填上述流程中的编号)的循环。上述流程中X物质的分子式为_______________。写出沉淀中发生的化学反应方程式_______________,从沉淀池中取出沉淀的操作是_______________
(3)在实验室可以利用Na2CO3溶液通过一步反应可获得NaOH,请写出该反应的化学方程式_______________
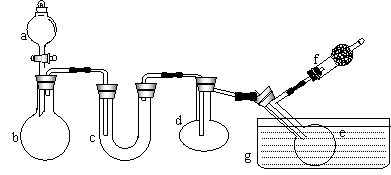
18、(9分)已知三氯化磷和五氯化磷的有关物理量如下表。某学生拟用下图所示装置(酒精灯、铁架台等未画出)制取三氯化磷。实验时,在蒸馏烧瓶d中放入足量白磷,将氯气迅速而又不间断地通入蒸馏烧瓶d 中,氯气与白磷发生反应,并产生火焰。请回答下列问题:
|
|
熔点 |
 沸点 沸点 |
|
三氯化磷 |
-112℃ |
76℃ |
|
五氯化磷 |
148℃ |
200℃分解 |
(1)有浓盐酸、浓硫酸、白磷、二氧化锰、氢氧化钠等物质供选用,a,b中应该装入的试剂分别是:
a、_____________b、_______________
(2)实验中需要加热的仪器有(填仪器对应的字母)________________________
(3)生成的三氯化磷在蒸馏烧瓶e中收集,为保证三氯化磷蒸气完全冷凝,在水槽g中应加入:_______
(4)三氯化磷遇到水蒸气强烈反应,甚至发生爆炸,所以d、e仪器及盛放其中的物质都应是干燥的。为除去氯气中的水分并防止外界的水分进入 装置,c中应装入下列物质中的(填字母,下同)_____,F中应装入下列物质中的 ____________
A、碱石灰 B、浓硫酸 C、无水氯化钙
(5)氯气和白磷反应放出大量的热,为使蒸馏烧瓶d不致因局部过热而炸裂,实验开始前应在蒸馏烧瓶d的底部入放少量:______________
(6)蒸馏烧杯e中收集到的三氯化磷中常含有少量的五氯化磷,请设计实验将三氯化磷与五氯化磷分离:______________________
17、(8分)现有质量分数为98%,密度为1.84g/cm3的浓H2SO4来配置500ml0.2mol/L的稀H2SO4。可供选择的仪器有:①玻璃棒 ②试管 ③烧杯 ④胶头滴管 ⑤量筒 ⑥容量瓶 ⑦托盘天平⑧药匙。请回答下列问题:
(1)上述仪器中,在配制稀H2SO4时用不到的有:(填序号,下同)___________________
(2)经计算,需浓硫酸的体积为_________。现有①10mL ②50 mL③100 mL三种规格的量筒,你选用的量筒是:__________
(3)将浓硫酸用适量蒸馏水稀释后,冷却片刻,随后全部转移到500 mL容量瓶中,转移时应用_____引流。转移完毕,用少量蒸馏水洗涤烧杯2~3次,并将洗涤液全部转移到容量瓶中,再加适量蒸馏水,轻晃容量瓶,使溶液混合均匀。然后缓缓地把蒸馏水直接注入容量瓶,直到液面接近刻度______处,改用______滴加蒸馏水到瓶颈刻度的地方,使溶液的______正好与刻度线相切。振荡摇匀后,装瓶贴签。
(4)在配制过程中,下列操作能引起结果偏高的有:______________________________
①洗涤量取浓硫酸后的量筒,交将洗涤液转移到容量瓶中
②未等稀释后的硫酸溶液冷却至室温就转移到容量瓶中
③将浓硫酸倒入烧杯,再向烧杯中注入蒸馏水来稀释浓硫酸
④定容前,加蒸馏水超过刻度线,又用胶头滴管吸出
⑤转移前,容量瓶中有少量蒸馏水
⑥定容摇匀后,发现液面低于刻度线,再用胶头滴管加蒸馏水至刻度线
⑦定容时,俯视刻度线
16、下列各组物质仅用蒸馏水不能鉴别出的是:
A、苯、酒精、硝基苯 B、食盐、烧碱、硝酸铵
C、蔗糖、硫酸铜粉末、碳酸钙粉末 D、氧化铜、二氧化锰、活性炭
第Ⅱ卷 (非选择题)
15、下列实验操作中,先后顺序正确的是:
A、稀释浓硫酸时,先在烧杯中加入一定体积的浓硫酸,后注入蒸馏水
B、为测定硫酸铜晶体的结晶水含量,称样时,先称取一定量的晶体,后放入坩埚中
C、为检验酸性溶液中的Cl-和SO42-,先加硝酸银溶液,滤去沉淀后加硝酸钡溶液。
D、在制取干燥纯净的氯气时,先使氯气通过水(或饱和食盐水),后通过浓硫酸
14、在密闭容器中充入CO2和CO的混合气体,其密度是相同条件下氦气的8倍,这时测得容器内的压强为p1。若控制容器的体积不变,加入足量的Na2O2,充分振荡并不断用电火花点燃至反应完全,恢复到开始 时的温度,再次测得容器内的压强为P2,则P1和P2之间的关系是:
A、P1= 8 P2 B、P1= 4 P2 C、P1 = 2 P2 D、P1= P2
13、氢化亚铜(CuH)是一难溶物质,用CuSO4溶液和另一种“反应物”在40~50℃时反应可生成它。CuH不稳定易分解,在氯气中能燃烧,跟盐酸反应能产生气体。以下有关它的推断中错误的是:
A、这里的“另一种反应物”具有氧化性 B、CuH可作氧化剂、还原剂
C、CuH + Cl2 = CuCl + HCl(燃烧) D、CuH + HCl = CuCl + H2↑(常温)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com