
题目列表(包括答案和解析)
28.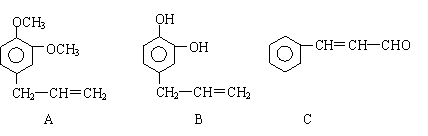 从某些植物树叶提取的挥发油中含有下列主要成分:
从某些植物树叶提取的挥发油中含有下列主要成分:
(1)写出A的分子式 。
(2)1molB与溴水充分反应,需消耗 mol单质溴。
(3)写出C在一定条件下与足量H2反应的化学方程式:
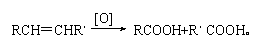 。
。
(4)已知: 写出C在强氧化剂条件下生成的有机化合物的结构简式 。
(5)写出A与B在一定条件下相互反应,生成高分子化合物的化学方程式:
。
27.各地电视台的天气预报中都要预报城市的空气质量。预报中一般将城市空气中的SO2含量和可吸入颗粒的含量(可用g/cm3表示)分为8个等级。目前,测定空气中SO2含量时主要用一些氧化还原反应。
已知:SO2气体与酸性KMnO4溶液反应时,MnO4-被还原为Mn2+,SO2被氧化为SO42-。
现有药品:0.1mol/L的酸性KMnO4溶液、颗粒吸附剂、品红试纸、pH试纸。
完成下列各题:
(1)配制200mL0.1mol/L的酸性KMnO4溶液需用的仪器有 、 、玻璃棒、胶头滴管、烧杯等,玻璃棒的作用是引流和 。
(2)在测定SO2和可吸入颗粒时,首先应测定 ,原因是
。
(3)写出SO2与酸性KMnO4溶液反应的离子方程式:
;
若气体的流速为a cm3/min,当t min时,200mL0.1mol/L的酸性溶液恰好褪色,则空气中SO2的含量为 (g/cm3)。
(4)若要测定空气中可吸入颗粒的含量,需要测出的数据有
。
26.在实验室中拟用氧化铜、稀硫酸和锌来制取纯净的铜,甲、乙两位同学分别设计了如下实验方案:
甲:①把CuO溶于适量稀硫酸中;②在①的溶液中加入适量Zn,充分反应后过滤、烘干,即得纯净的Cu。
乙:①锌与稀H2SO4反应制H2;②将H2通入CuO中并加热,充分反应后即得纯净的Cu。
回答下列问题:
(1)若要制得相同质量的纯Cu,所消耗的锌和稀硫酸的量是:甲 乙(填“大于”、“小于”或“等于”),原因是
。
(2)丙同学认为上述两种方案所制得的Cu都难以保证Cu的纯度,应对上述两种方案加以完善。你 (填“是”或“否”)赞同丙同学的看法。
理由①(对甲同学实验而言) ,②(对乙同学实验而言) 。
(3)请你分别对甲、乙两同学的实验加以完善:
① ;
② 。
25.高炉炼铁中发生的基本反应之一如下:FeO(s)+ CO(g)→Fe(s)+ CO2(g)-Q(Q>0)。(1)此反应的平衡常数表达式为;K= ;
(2)温度升高,化学平衡移动后达到新的平衡,高炉内CO2和CO的体积比值 ,平衡常数K值 (填“增大”、 “减小”或“不变”。);
(3)已知1100℃时,K= 0.263,此时测得高炉中c(CO2)= 0.025mol/L,c(CO)= 0.1mol/L,在这种情况下,该反应 (填“是”或“没有”)处于化学平衡状态,此时化学反应速率是v正 v逆(填“大于”、“小于”或“等于”),其原因是 。
24.(8分)含两种元素的化合物E与NH3反应,生成化合物G和H2,化合物G的相对分子质量约为81,G分子中硼元素和氢元素的质量分数分别是40%和7.4%,由此推断:
(1)化合物G的分子式为 ;
(2)反应消耗1mol E可生成4molH2,组成化合物E的元素是 和 ;又已知:1molE和2molNH3恰好完全反应,化合物E的分子式是 ;
(3)化学上把原子数和电子数均相等的微粒称为等电子体(例如CH4和NH4+为等电子体),化合物G的某种等电子体是一种常见的有机物F,F在常温下为液态,其分子中的原子都在一个平面上,则F的分子式为 ;
(4)等电子体具有相似的结构和性质,试写出G分子的结构简式: 。
23.(8分)H2O2是一种重要的氧化剂,亦具有还原性。下列①~④个涉及H2O2的反应(未配平、条件略)。
①Na2O2 + HCl→NaCl + H2O2
②H2O2 →H2O + O2
③Ag2O + H2O2 →Ag + O2 + H2O
④H2O2 + Cr2(SO4)3+KOH→K2CrO4+K2SO4+H2O。
据此,填写下列空白:
(1)配平上述反应④
[ ]H2O2 +[ ]Cr2(SO4)3+[ ]KOH→[ ]K2CrO4+[ ]K2SO4+[ ]H2O
当0.1mol氧化剂参加反应时,转移电子 个。
(2)H2O2仅体现还原性的反应是 (填代号),此反应中的氧化产物为 。
(3)H2O2体现弱酸性的反应是 (填代号),其理由为
。
22.常温时0.1mol/LHA溶液的pH > 1,0.1mol/LBOH溶液中c(OH-)∶c(H+)=1012,将两溶液等体积混合,以下判断正确的是( )
A.c(H+)< c(OH-)< c(A-)< c(B+) B.c(OH-)< c(H+)< c(B+)< c(A-)
C.c(H+)+ c(B+)= c(A-)+ c(OH-) D.c(A-)= c(B+)>c(H+)= c(OH-)
第Ⅱ卷(共84分)
21.有机物甲发生银镜反应,甲催化加氢还原成有机物乙,1mol乙跟足量的金属钠反应放出标准状况下氢气22.4L,据此推断乙一定不是( )
A.HOCH2CH2OH B.HOCH2CH(OH)CH3
C.CH3CH2CH2OH D.CH3CH(OH)CH(OH)CH3
20.设NA表示阿伏加德罗常数,下列叙述中正确的是( )
A.80g硝酸铵含有氮原子数为2 NA
B.常温常压下,22.4L的D2、H2组成的气体分子数为NA
C.标准状况下,2.24LSO3中含有的氧原子数为0.3 NA
D.1molNa2O2与足量CO2反应转移的电子数NA
19.为提纯下列物质(括号内的物质是杂质),所选用的除杂试剂和分离方法都正确的是( )
|
|
被提纯的物质 |
除杂试剂 |
分离方法 |
|
A |
溴化钠溶液(NaI) |
氯水、CCl4 |
萃取、分液 |
|
B |
氯化铵溶液(FeCl3) |
氢氧化钠溶液 |
过滤 |
|
C |
二氧化碳(CO) |
氧化铜粉末 |
通过灼热的CuO粉末 |
|
D |
苯(苯酚) |
浓溴水 |
过滤 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com