
题目列表(包括答案和解析)
19、(6分)今用铝、稀硫酸和氢氧化钠溶液为原料,实验室制备一定量的氢氧化铝。分别采用如下化学方程式所表示的两种方法:①2Al+3H2SO4=Al2(SO4)3+H2↑Al2(SO4)3+6NaOH=2Al(OH)3↓+3Na2SO4 ②2Al+2NaOH+2H2O=2NaAlO2+3H2↑2NaAlO2+H2SO4+2H2O=2Al(OH)3↓+Na2SO4
⑴请问上述哪一种方法比较节约试剂?(提示:试从每生产2molAl(OH)3所耗费的试剂用量予以说明。)
⑵原料相同,请设计一种更为节约试剂的方法(以方程式表示,并说明其可以最节约试剂的根据)。
18、(4分)3.2g铜与过量硝酸(8mol·L-1 、30mL)充分反应,硝酸的还原产物有NO2和NO。反应后溶液中所含H+为amol,则此进溶液中所含NO3-为 mol。
17、工业制纯碱时,第一步是通过饱和食盐水、氨和二氧化碳反应,获得碳酸氢钠结晶,它的反应原理可以用下面的方程式表示:NH3+CO2+H2O=NH4HCO3
NH4HCO3+NaCl(饱和)=NaHCO3↓+NH4Cl
以上反应的总结果是放热反应。请设计一个实验:用最简单的实验装置模拟实现这一过程,获得碳酸氢钠结晶。可供选择的实验用品有:6 mol·L-1盐酸,6mol·L-1硫酸,浓氨水,氢氧化钠、消石灰、石灰石、氯化铵、食盐、蒸馏水和冰,以及中学化学实验常用仪器。
⑴画出实验装置示意图(包括反应时容器中的物质),并用图中玻璃容器旁自基至右分别用A、B、C……符号标明(请见题后说明)
⑵请写出在图上用A、B、C……各玻璃容器中盛放物质的化学式或名称。A:
B: C: D: E:
⑶利用在本题所提供的实验用品,如何判断得到的产品是碳酸氢钠的结晶,而不是碳酸氢铵或食盐结晶。 答:
说明:①本题装置示意图中的仪器可以用下面的方式表示。


敞口玻璃容器 有塞玻璃容器 玻璃漏斗 分液漏斗

 玻璃导管
(但应标示出在液面上或液面下)
玻璃导管
(但应标示出在液面上或液面下)
②铁架台、石棉网、酒精灯、玻璃导管之间的联接胶管等,在示意图中不必画出。如需加热,在需加热的仪器下方,标以“△”表示。
16、若0.01mol·L-1的HF酸之电离度为α,则在1L该溶液中,H+、F- 离子和HF分子的总数是
A 0.02α B (1+2α)×6.02×1021 C 0.01+α (1+α) ×6.02×1021
第Ⅱ卷
(共四大题,8小题,66分)
15、若200mL[H+]=1×10-3mol·L-1的某一元酸和100mL[OH-]=1×10-3mol·L-1的某一元碱相混合后,溶液呈碱性。所用的酸和碱应是
A 等浓度的弱酸和强碱 B 稀的强酸和稀的强碱
C 稀的弱酸和浓的强碱 D 稀的强酸和浓的弱碱
14、将0.1mol·L-1HCOONa与0.05mol·L-1HCl等体积混合后,溶液中各微粒的物质的量浓度的大小关系是
A [Cl-1]=[HCOOH]=[HCOO-]>[H+] B [Cl-1]= [HCOO-]> [HCOOH]> [H+]
C [HCOO-]> [Cl-1]> [H+] >[HCOOH] D [HCOO-]> [Cl-1] >[HCOOH] >[H+]
13、向各盛有1L水的A、B、C、D四个烧杯中分别加入等物质的量的钠、氧化钠、过氧化钠和氢氧化钠,固体完全溶解后,各杯溶液中溶质的质量分数(即质量百分比浓度)的顺序是
A D>C>B>A B B=C>A>D C B=C>A=D D B>C>A>D
12、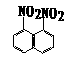 在一定条件下,萘可以被硝硫混酸硝化生成二硝基物,它是1.5-二硝基萘
在一定条件下,萘可以被硝硫混酸硝化生成二硝基物,它是1.5-二硝基萘
和1.8-二硝基萘 的混合物。后者可溶于质量分数大于98%的硫酸,而前者不能。利用这个性质可以将这两种异构体分离。将上述硝化产物放入适量的98%硫酸,充分搅拌,用耐酸漏斗过滤,欲从滤液中得到固体1.8-二硝基萘,应彩的方法是
A 蒸发浓缩结晶 B 向滤液中加入水后过滤
C 用Na2CO3溶液处理滤液 D 将滤液缓缓加入水中
11、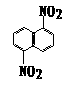 将ag氯化钾溶于1.8L水中,恰好使k+离子数与水分子数之比为1:100,则a值为
将ag氯化钾溶于1.8L水中,恰好使k+离子数与水分子数之比为1:100,则a值为
A 0.745 B 0.39 C 39 D 74.5
10、固体A 在一定温度下分解生成气体B、C、D:2A=B+2C+3D,若测得生成气体的质量是相同体积的H2的15倍,则固体A的摩尔质量是
A 30g·mol-1 B 60g·mol-1 C 90g·mol-1 D 120g·mol-1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com