
题目列表(包括答案和解析)
19.下面是关于硫化氢的部分文献资料

 某研究性学习小组对资料中“氢硫酸长期存放会变浑浊”这一记载十分感兴趣,为了探究其原因,他们分别做了如下实验:
某研究性学习小组对资料中“氢硫酸长期存放会变浑浊”这一记载十分感兴趣,为了探究其原因,他们分别做了如下实验:
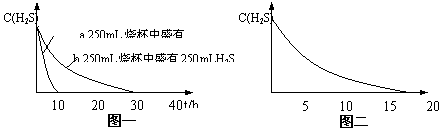 实验一:将H2S气体溶于蒸馏水制成氢硫酸饱和溶液,在空气中放置1-2天未见浑浊现象。用相同浓度的碘水去滴定氢硫酸溶液测其浓度。图一所示为两只烧杯中氢硫酸浓度随时间变化而减小的情况。
实验一:将H2S气体溶于蒸馏水制成氢硫酸饱和溶液,在空气中放置1-2天未见浑浊现象。用相同浓度的碘水去滴定氢硫酸溶液测其浓度。图一所示为两只烧杯中氢硫酸浓度随时间变化而减小的情况。
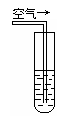
实验二:密闭存放的氢硫酸,每天定时取1mL氢硫酸,
用相同浓度的碘水滴定,图二所示为氢硫酸浓度随放置天
数变化的情况。
实验三:在饱和氢硫酸溶液中以极慢的速度通入空气
(1-2个气泡/min),数小时未见变浑浊的现象。
实验四:盛满试剂瓶,密闭存放的饱和氢硫酸溶
 液隔2-3天观察,直到略显浑浊;当把满瓶的氢硫酸
液隔2-3天观察,直到略显浑浊;当把满瓶的氢硫酸
倒扣在培养皿中观察2-3天,在溶液略显浑浊的同时,
瓶底仅聚集有少量的气泡,随着时间的增加,这种气泡
也略有增多(大),浑浊现更明显些。请回答下列问题:
(1) 实验一(见图一)中,氢硫酸的浓度随时间变化而减小
的主要因素是 硫化氢的挥发 。
(2)实验一和实验二中,碘水与氢硫酸反应的化学方程式
为 H2S+I2==2HI+S↓ 。两个实验中准确判断碘水与氢硫酸
恰好完全反应是实验成功的关键。请设计实验方案,使实验者准确掌握所加碘水恰好与氢硫酸完全反应。 向氢硫酸中加入淀粉液,滴加碘水到溶液刚好呈蓝色 。
(3) “氢硫酸长期存放会变浑浊”中,出现浑浊现象是由于生成了S或硫的缘故。
(4)该研究性学习小组设计实验三说明他们认为“氢硫酸长期存放会变浑浊”的假设原因之一是(用文字说明) 氢硫酸被空气中氧气氧化 。此实验中通入空气的速度很慢的主要原因是什么? 防止因通入空气过快而使硫化氢大量挥发 。
(5)实验四的实验现象说明“氢硫酸长期存放会变浑浊”的主要原因可能是 硫化氢自身分解 。为进一步证实上述原因的准确性,你认为还应做哪些实验(只需用文字说明实验设想,不需要回答实际步骤和设计实验方案)? 确证生成的气体是氢气 。
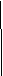
18.己知:①乙醛甲基上的氢原子都是α氢原子,活性较大,都可以与甲醛中的醛基发生加成反应。如:HCHO+CH3CHO HO-CH2CH2-CHO
HO-CH2CH2-CHO
②

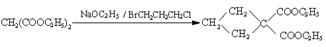
现由乙烯和丙二酸等物质合成Ⅰ,合成路线如下:
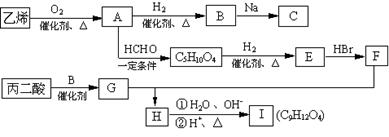
请回答下列问题:
⑴写出下列物质的结构简式:
E ,H ,I ;
⑵写出A→C5H10O4的化学方程式。
17.两种非金属元素X、Y在元素周期表中彼此相隔一个周期,它们的单质Xm、Yn和水在一定条件下能发生反应:Xm+Yn+H2O→HY+H3XO4+XH4Y(未配平)。(m、n均为大于1的正整数)
⑴若Xm、Yn在常温下均为常见固体,则Xm是 P4 ,Yn是 I2 ;
⑵试根据推断后,完成(配平)上述化学方程式:
P4+2I2+8H2O 2HI+2H3PO4+2PH4I
;
⑶试解释下列两反应能进行的原因:
①HY(aq)+NaH2XO4(aq)=H3XO4(aq)+NaY(aq),理由是 因为酸性(或电离程度)HI>H3PO4 ;
②H3XO4(浓)+NaY(固)=HY+NaH2XO4,理由是: 该反应在一定条件下是可逆反应,由于HI挥发,促进平衡朝生成正反应方向移动 。
16.⑴在定量实验中,采用下列操作会导致实验结果偏低的是 ABD (填代号)。
A.中和热测定实验中以环形铁丝搅拌棒代替环形玻璃搅拌棒
B.配制100mL 2 mol/L的NaCl溶液,以胶头滴管加水定容时,液面稍超出容量瓶刻度线,反复摇匀后,凹液面最低点恰好与刻度线平齐
C.测定硫酸铜晶体结晶水含量,加热并搅拌时,有少量固体溅出。
 D.称取一定质量无水碳酸钠粉末,用稀盐酸滴定(用甲基橙作指示剂),测定盐酸浓度。酸式滴定管用蒸馏水润洗后未用待装液润洗,立即装液、滴定。
D.称取一定质量无水碳酸钠粉末,用稀盐酸滴定(用甲基橙作指示剂),测定盐酸浓度。酸式滴定管用蒸馏水润洗后未用待装液润洗,立即装液、滴定。
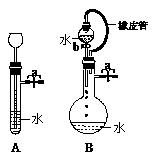
⑵根据右图描述回答下列问题:
①关闭图A装置中的止水夹a后,从长颈漏斗向试管
中注入一定量的水,静置后如图所示。试判断:A装置是
否漏气?(填“漏气”、“不漏气”或“不能确定”) 不漏气 ;
②关闭图B装置中的止水夹a后,开启活塞b,水不断
往下滴,直至全部流入烧瓶。试判断:B装置是否漏气?
(填“漏气”、“不漏气”或“不能确定”) 不能确定 ,判理由 不管装置是否漏气,烧瓶内气压与漏斗上方的气压相等,水在重力作用下可完全流入 。
15.向含下列微粒的溶液中,①HS-、②Fe2+、③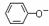 、④
、④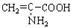 分别加入少量氢氧化钠固体,或少量浓盐酸或几滴酸性KMnO4溶液。(溶液体积变化忽略不计),都使溶液中对应的离子或分子浓度减少的是
分别加入少量氢氧化钠固体,或少量浓盐酸或几滴酸性KMnO4溶液。(溶液体积变化忽略不计),都使溶液中对应的离子或分子浓度减少的是
A.①② B.②③ C.①④ D.③④
14.下列说法正确的是
A.1molH2SO4与1mol Ba(OH)2完全中和所放出的热量为中和热
B.中和反应都是放热反应,盐类水解反应都是吸热反应
C.在101kPa1mol碳燃烧所放出的热量一定是碳的燃烧热
D.碳与二氧化碳的反应既是放热反应,也是化合反应
13.常温下某溶液中由水电离产生的[H+]=1×10-5mol/L,则下列叙述正确的是
A.pH值为5 B.一定是酸溶液 C.可能是强酸的酸式盐溶液 D.PH值可能为9
12.臭氧分子的结构与SO2(极性分子)相似,可读做二氧化氧,在臭氧层中含量达0.2 ppm(ppm表示百万分之一)。臭氧是氧气吸收了太阳的波长小于242 nm的紫外线形成的,不过当波长在220 nm-320 nm的紫外线照射臭氧时,又会使其分解。下列说法中正确的是
A.打雷时也能产生臭氧,臭氧分子是直线型分子
B.臭氧转化为氧气和氧气转化为臭氧均须吸收能量
C.臭氧和氧气的相互转化能保持大气中臭氧的含量基本稳定
D.向大气中排放的氮的氧化物和氟氯代烃均能还原臭氧,使臭氧的量减少
11.某氢氧化钠溶液跟醋酸溶液混合后溶液呈酸性,
则混合溶液中离子的物质的量浓度之间关系一定正确的是CD
A.c(Na+)+c(H+)=c(CH3COO-) B.c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
C.c(CH3COO-)>c(Na+)>c(H+)>c(OH-) D.c(H+)=c(CH3COO-)-c(Na+)+c(OH-)
10.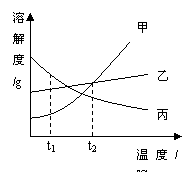 甲、乙、丙三种固体物质的溶解度曲线如右图所示,
甲、乙、丙三种固体物质的溶解度曲线如右图所示,
下列有关说法中正确的是
A.t1℃时甲物质的溶解度最大
B.乙物质的溶解度不随温度升降而变化
C.丙物质的溶解度随温度升高而降低
D.t2℃时甲、乙、丙三种物质的溶解度相等
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com